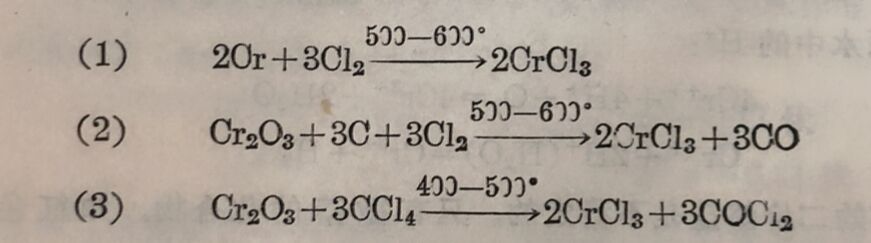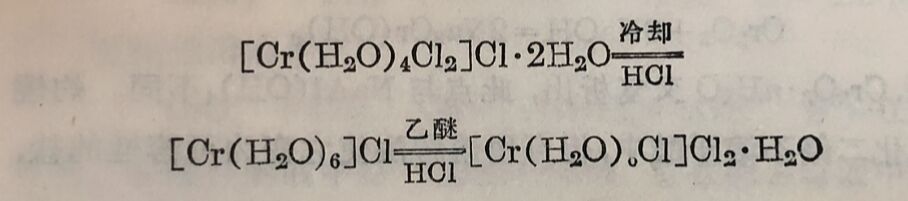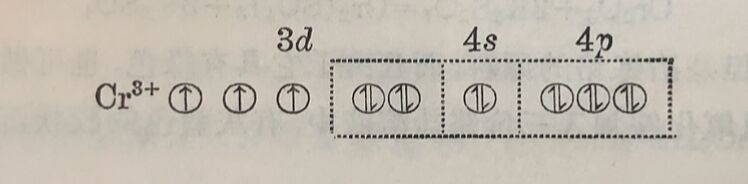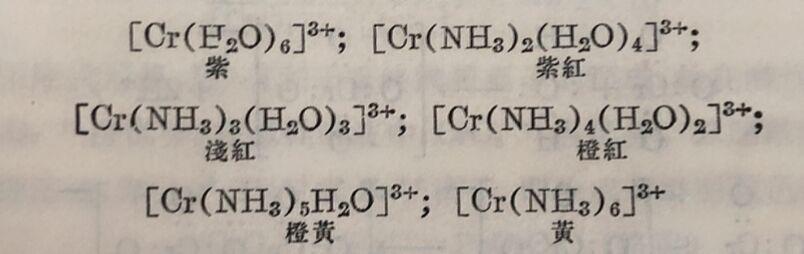鉻的化合物
铜臭 / 2022-08-08
在化合物中,饰最常见的价态是+2, +3和+6。
二价鉻的化合物二价铁的化合物相似。但从标准电极电位可见,Cp⁺⁺的还原能力比Fe⁺⁺强得多。
Fe³⁺+e=Fe⁺⁺ E⁰=0.77伏
Cr³⁺+e=Cr⁺⁺ E⁰=0.41伏
固体二价鉻的化合物遇潮湿空气就氧化,故需保存在真空中。二价路离子显碱性,稍有水解作用。
三价鉻的化合物与三价铁的化合物相似,但比救容易被氧化。水合三价路离子[Cr(H₂O)₆]³⁺是紫色,星现两性,强烈地水常,易略合。它与三价鋁蔼子的性质也有些相似,因为它們的离子半徑相近(Al³⁺,0.57Å;Cr³⁺,0.64Å),例如两种金屬的氧化物、氟化物和氯化物都是同品,都可以形成矾类。不溶于水的三 价路的化合物具有深的颜色,如Cr₂O₃是深绿色,Cr₂S₃是黑色,CrOl₃是紅紫色。
六价鉻常以黄色的路酸根离子CrO₄⁻⁻或橙色的重路酸根离子Cr₂O₇⁻⁻存在于溶液中。从下面的标准电极电位:
在酸性溶液中,
Cr₂O₇⁻⁻+14H⁺+6e=2Cr³⁺+6H₂O E⁰=1.3伏
在碱性溶液中,
CrO₄⁻⁻+4H₂O+3e=Cr(OH)₃+5OH⁻ E⁰=0.13伏
可知,在酸性溶液中鉻⁽ᵛᴵ⁾是强氧化剂,而在碱性溶液中路四可以被氧化为CrO₄⁻⁻。
1.二价化鉻合物
二价鉻的强酸盐大多数是蓝色的,如CrCl₂·4H₂O, CrSOr₄·7H₂O。在二价铬盐溶液中加入氮水后,可使黄色Cr(OH)₂析出,如与铁盐共存,则无沉论作用;二价路盐都能吸收NO。上述两种情况与二价铁盐相似。
Cr⁺⁺在溶液中是强还原剂,它不但可以还原空气中的收而且 可以还原水中的H⁺:
4Cr⁺⁺+4H⁺+O2=4Cr³⁺+2H₂O
Cr⁺⁺+2H⁺(H₂O)=Cr³⁺+H₂
因此可溶的二价路盐是不稳定的。只有微溶的化合物,如紅色的[Cr(CH₃COO₂)₂·2H₂O和红棕色的CrI₂或络合物,如[Cr(N₂H₄)n]I₂,才能在溶液中存在。
2.三价鉻化合物
(i)氧化铬⁽ᴵᴵᴵ⁾和氢氧化鉻⁽ᴵᴵᴵ⁾将重鉻酸銨加热分解, 可得綠色的氧化鉻Cr₂O₃:
(NH₄)₂Cr₂O₇=N₂+Cr₂O₃+4H₂O
此外,用硫或碳还原重鉻酸鈉,也可得到同样的产物:
Na₂C₂O₇+S=Cr₂O₃+Na₂SO₄
Cr₂O₃与α-Al₂O₃同晶,微溶于水,熔点为1990°,呈現两性,溶于酸中,形成[Cr(H₂O)₆]³⁺,溶于浪的强碱中,形成深綠色的亚鉻酸盐:
Cr₂O₃+6NaOH=2Na₃Cr(OH)₆
加热煮沸,Cr₂O₃·nH₂O又复析出,此点与NaAl(OH)₄不同。灼燒过的三氧化二路不溶于酸中,但可用熔融法使它变为可溶性的盐,如
Cr₂O₃+3K₂S₂O₇=Cr₂(SO₄)₃+3K₂SO₄
Cr₂O₃不但是冶炼铬的原料,而且由于它具有绿色,也可做为颜料。
把氫氧化銨加入三价鉻盐溶液中,有灰藍色的胶状沉淀产生,它是水合氧化鉻Cr₂O₃·nH₂O,常称为氨氧化铬⁽ᴵᴵᴵ⁾。
(i)氯化鉻⁽ᴵᴵᴵ⁾ 无水三氯化路可用 下列三种方法之一来制备: (1)通干燥的氯气于紅热的鉻上; (2)氨化紅热的氧化鉻和碳; (3)三氧化二鉻与四氯化碳共热。
无水三氯化鉻呈紅紫色,不易溶于冷水中,但如有微量的CrCl₂存在,可使它很快地溶解成暗綠色溶液。将溶液蒸发,即析出暗綠色晶体,它的实驗式为CrCl₃·6H₂O。用水将晶体溶解,幷加入硝酸銀,只有一个氯离子形成AgCl而沉淀出来。在干燥器中用硫酸将晶体脱水,只有两个分子水可以去掉。这些秸果证明有四个水分子和二个氯离子是配位在中心鉻离子的内界。因此綠色 氯化鉻的结构式应为[Cr(H₂O)₄Cl₂]Cl·2H₂O。
如将暗綠色溶液冶却至0°以下并通入HCI气体,則析出的是紫色晶体,用上述的方法可证明它的结构式为[Cr(H₂O)₆]Cl₃。紫色晶体溶液以乙醚处理并通以HCI气体后,就析出另外一个淡綠色晶体,其秸构式为[Cr(H₂O)₅Cl]Cl₂·H₂O。三者間的轉化表示如下:
鉻⁽ᴵᴵᴵ⁾离子的配位数是6,屬于d²sp³鍵型。
内界中的水分子可被其他配位体置换,例如
由于进大内界的氨分子数目的不同,顏色向长波方面变化。
(iii)硫酸鉻⁽ᴵᴵᴵ⁾将三氧化二鉻溶于冷的濃硫酸中,則得深紫色的硫酸铬⁽ᴵᴵᴵ⁾Cr₂(SO₄)₃·18H₂O。此外,还有绿色的水合晶体Cr₂(SO₄)₃·6H₂O。无水盐是桃紅色。它与CrCl₃相似,需有微量的强还原剂存在时才易溶于水。它与碱金屬硫酸盐形成鉻矾 M⁽ᴵᴵᴵ⁾Cr(SO₄)₂·12H₂O (M⁽ᴵ⁾=Na⁺、K⁺、Rb⁺、Cs⁺、NH⁺、T⁺)。用SO₂还原重鉻酸鉀的酸性溶液,可以制得鉀鉻矾:
K₂Cr₂O₇+H₂SO₄+3SO₂=K₂SO₄·Cr₂(SO₄)₃+H₂O
鉻矾广泛地应用于鞣革工业和新織工业。
3.六价鉻化合物
(i)三氧化铬 浓的重鉻酸鉀溶液用过量的濃硫酸处理, 則有橙紅色的三氧化鉻CrO₃品体析出:
K₂Cr₂O+H₂SO₄=K₂SO₄+2CrO₃+H₂O
三氧化路的熔点为167°,热稳定性差,超过熔点不但开始气化而且.逐步分解:
CrO₃→Cr₃O₈→Cr₂O₅→CrO₂→Cr₂O₃