判断氧化剂、还原剂的相对强弱
电极电势代数值越小,电对所对应的还原型物质的还原能力越强,氧化型物质的氧化能力越弱。电极电势代数值越大,电对所对应的氧化型物质的氧化能力越强,还原型物质的还原能力越弱。
例如,已知 φθ(Cl2/Cl-)=1.36V
φθ(Fe3+/Fe2+)=0.77V
φθ(Cu2+/Cu)=0.34V
可知,氧化型物质的氧化能力Cl2>Fe3+>Cu2+,还原型物质的还原能力Cu>Fe2+>Cl-。
判断氧化还原反应进行的方向
恒温恒压下化学反应自发进行的条件是△G<0。氧化还原反应组成原电池的电动势与其△G的关系表示为
△G=-nFE
在标准状态下:△Gθ=-nFEθ
在任意状态下,氧化还原反应方向的判断遵循以下规律。
△G<0,E>0,反应向正向进行
△G=0,E=0,处于平衡状态
△G>0,E<0,反应向逆向进行
用电池电动势E判断氧化还原反应进行的方向时,若某一种反应物质的浓度或分压未知,可利用标准电池电动势Eθ,用以下经验规则判断氧化还原反应进行的方向。
Eθ>0.2V,反应向正向进行
Eθ<-0.2V,反应向逆向进行
0.2V<Eθ<0.2V,不能确定
计算氧化还原反应进行的程度
根据电池反应的Nernst方程式(25℃):
E=Eθ-(0.059/n)lgJ
当氧化还原反应处于平衡时,E=0,J=Kθ,则氧化还原反应平衡常数与标准电池电动势的关系为
lgKθ=nEθ/0.0592 (3-9)
当n=2,Eθ≥0.2V时,Kθ≥5.7×106,反应进行很完全。
当n=2,Eθ≤-0.2V时,Kθ≤1.7×10-7,反应基本不进行。
元素电势图及其应用
一些元素具有多种氧化态,为了直观地了解各氧化态之间的关系,把各氧化态之间所构成的电对的标准电极电势用图形表示出来,这种图形叫做元素电势图,亦称还原电势图。
在元素电势图中,从左至右,元素的氧化态由高到低排列,两种氧化态之间以直线连接,在直线上标明该电对的标准电极电势。例如,氯元素在酸性介质中的电势图为(图中数字单位为V)
H2O2处于中间氧化态,因此,它既可以做氧化剂,又可以做还原剂。
元素电势图的应用:
(1)判断歧化反应是否发生。在元素电势图中,如果某一氧化态物质与其右边低氧化态物质构成电对的标准电极电势φθ(右),大于它与其左边高氧化态物质构成电对的标准电极电势φθ(左),该氧化态物质就可能发生歧化反应,生成相邻的两种氧化态物质。反之,歧化反应不能自发进行,而歧化反应应的逆反应可以自发进行。
在氧的元素的电势图中,φθ(H2O2/H2O)>φθ(O2/H2O2),即φθ(右)>φθ(左),所以,H2O2能发生歧化反应
2H2O2(aq) = O2(g)+2H2O(l)
在酸性介质中,铁的元素电势图为
由于φθ(右)<φθ(左),Fe2+不能发生歧化反应,但其逆反应可以自发进行
2Fe3+(aq)+Fe(s) = 2Fe2+(aq)
该反应用来稳定亚铁离子的水溶液,防止亚铁离子被氧化为铁离子。
(2)计算某电对的标准电极电势。假定有一元素的电势图为
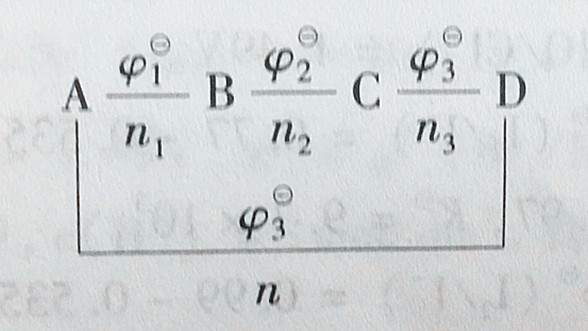
图中,ni为相邻氧化态的氧化数差值。从热力学可以推导出:
φθ=(n1φ1θ+n2φ2θ+n3φ3θ)/(n1+n2+n3) (3-10)
利用一些已知的标准电极电势和式(3-10),可以计算某些电对的未知标准电极电势。