





![1,8-二氮杂二环[5.4.0]十一碳-7-烯](images/201812/thumb_img/1103_thumb_G_1545291985569.jpg)

























合乎逻辑地下一个将要讨论当两个化合原子或离子中共有三三个电子时将会出现何种情况。由于os成键轨道仅能容纳两两个电子,在这种情况下,三个电子中的一个将充填到σ*s。反键轨道中,尽管它的能量比成键分子轨道或两个原子轨道的能量都高。这种反键轨道的利用情况可以用一个氨原子(He)同一个氨离子(He+)相结合形成一个二氨离子的例子来说明。参见图5-5。
有如我们已经看到的氨原子有两个电子,两个电子都在18原子轨道中(表3-8)。氨离子(He)是失去一个电子后的氨原子。由于失去了一个带负电荷的电子,结果它带+1电荷。当氨原子和氨离子相结合时,两个电子占人能量较低的。成键轨
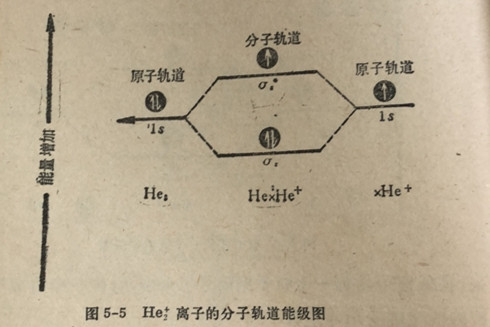
道中,第个电子占入次低能量的o*反键分子轨道中。这些情况可由图5-5的分子轨道道能级图来说明。
二氦离子的净能量比氨原子或氨离子的能量都稍低,因为有两个电子占入较低能量的分子轨道中和只有一个电子占入较高能量的分子轨道中。二氨离子具有较低的净能量表明一个氨原子和个氢离子有不小的结合成成二氨离子的倾向。
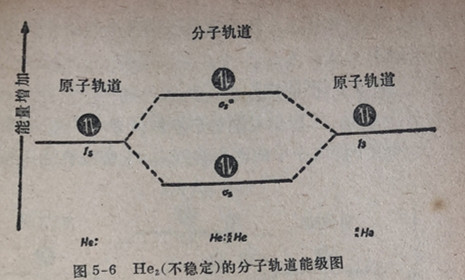
通过类似的理解方法,可以预期不容易由两个氨原子相结合形成具有四个电子的二氯分子(He2)。因为在低能量成键轨道中的两个电子将被高能量反键轨道中的两个电子所抵消。因此,能量的净变化将是零,表明氨原子没有结合成双原子分子的倾向。的确,象我们判断的一样,单质氨存在为单个的原子He,而不存在为双原子分子He2。参见图5-6。
把我们刚刚讨论的原理应用于第二周期元素(从锂到氖)去研究有否可能生成双原子分子是很有意思的。