众所周知,不受陆地水影响的海水中主要元素的含量比例,无论在世界上哪个地方都是一定的。对于为什么不论是太平洋还是大西洋、印度洋,主要元素素的含量比例都是一定的问题,克雷默报道过他的有独到见解的研究结果,他研究了溶解在海水中的10种主要成分,H+,Na+,K+,Ca2+,Mg2+,PO3-4,SO2-4,CI-,F-,CO2。认为这些溶存的化学形式和在海底沉积物中出现的矿物处于平衡,海水中这些元素的浓度就是由这种平衡关系来决定的。作为和离子处于平衡的矿物种类,其平衡常数应能精确测定,且必必须是在任何海域也都能见到的矿物。

就这10种元素的浓度来说,其阳离子与阴离子的当量数应该相等。此外,对氯离子来说,还没有发现适当的矿物与之处于平衡,而且海水中CI-的浓度在整个地质年代中总是一定的,大概可假设与现在海水中的CI-的浓度相等,为0.3当量。因此把这10种离子作为研究对象,除H+和CI-外列出后8种离子的矿物形式,测定平衡常数,解8个联立方程,就能算出各离子的浓度。这些矿物种类和平衡常数列于表4.4。但表4.4的计算中用的是离子浓度。因为海水中溶存离子之间能生成离子对和络合物,所以为了正确计算离子的浓度,还必须把表4.5中列出的方程与表4.4中列出的方程联立起来求解。解这些方程后得到的溶存元素的浓度如表4.6所列,把该计算的结果和现在海水中这些元素的浓度进行比较,显然相当一致。该结果揭示了非常重要的事实。


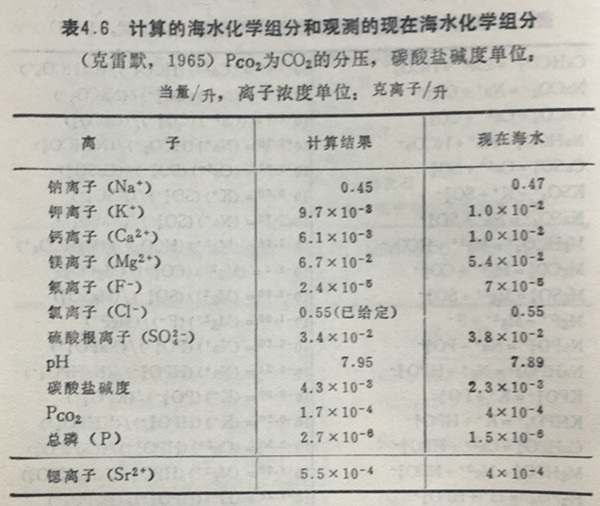
这就是说,只要认为无论在任何海域都能见到的(如表4,4中所列出的)矿物和海水处于平衡,再给出[CI-]数值,这样就可把海水中元素的浓度决定下来。从该结果来看,可知海水的pH值是由海水中的Ht和粘土矿物蒙脱石和伊利石中的Na+和K+的离子交换平衡来决定的。依据西林(L.G.Sillen,1963),霍兰(H.D.Holland,1965)等人的计算,若是上述粘土矿物和海水中H的交换平衡成立的话,那么海水的pH应该是8.0左右。这样得到的值与从海水中碳酸物质(CaCO3,H2CO3,HCO-3,CO2-3)的平衡关系(与上述粘土矿物丝毫没有关系)得到的pH值相一致(北野,1967)。若考虑海水的历史,由于认为CaCO3在海中出现以前,0.3NHCl就和硅酸盐岩石接触产生了粘土矿物,所以,就海水的pH历史来看,可以认为它是由粘土和海水的平衡关系来决定的。以后,因岩石中Ca2+,Mg2+,Na+,K+等的溶解,海水被中和,大气中的CO2オ溶于海水中,不久,即使能生成CaCO3,也不会导致海水的pH值发生改变。不管是克雷默还是西林,在处理包括固相CaCO3在内海水中碳酸物质平衡关系时,也一定包括大气中的CO2和海水中的H2CO3之间的平衡,这是极为重要的。之所以这样说,正如表4.6所示,若是给定了CI-的浓度,则含有H+的海水中主要溶存元素的浓度即可简单地被决定下来,并从而也就会使之与现在海水中主要元素的浓度吻合起来了。这还意味着CO2在大气中的分压也与现在大气的值相等。拿克雷默的处理方法来讨论海水的组成,正如刚才所述,实际也涉及到了大气中CO2的量。
这种处理方法确实很吸引人,但表4.4所列的矿物实际上是否在任何海底都存在呢?这是有疑问的。对这一点如果不作正确的探讨,就不应把克雷默的成果全盘原封不动地接受下来。