实验结果证明:蔗糖溶液和干燥氯化钠不能使灯泡发亮,说明它们都不能导电;而氯化钠溶液、氢氧化钠溶液、稀盐酸溶液以及熔融的氯化钠则能使灯泡发亮,说明它们都能导电。
化学上把溶解于水后或在熔融状态下能导电的物质叫做电解质,不能导电的物质叫做非电解质。例如,氯化钠、氢氧化钠、盐酸等都是电解质,蔗糖、酒精、甘油等都是非电解质。
为什么氯化钠溶液(或熔融状态下的氯化钠)、盐酸溶液等能够导电,而蔗糖溶液、干燥氯化钠等却不能够导电呢?
我们知道电流是由带电微粒定向移动而形成的,金属导电就是由于金属中自由电子的定向移动。物质溶于水后(或在熔融状态下)能够导电,那就说明在此溶液(或熔化而成的液体)里一定存在着能自由移动的带电微粒,这种微粒已证实不是电子而是离子。
电解质溶液里离子的形成与电解质的性质以及电解质和溶剂分子间的相互作用力有关。
2.电解质的电离过程。电解质电离成为离子的过程,分两种情况来讨论:
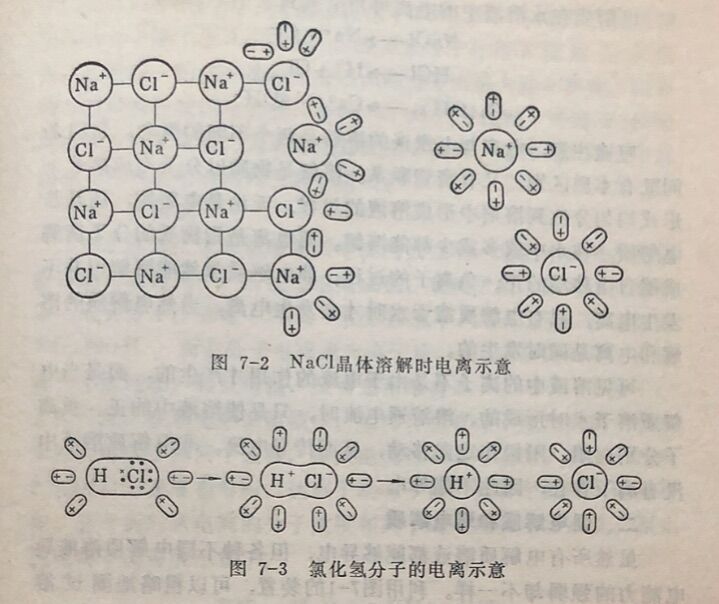
(1)离子型化合物。以氯化钠为例,氯化钠是由Na⁺和 Cl⁻构成的离子型晶体组成。呈固态时,虽然Na⁺和Cl⁻在不断振 动,但由于静电引力,Na⁺和Cl⁻相互吸引不能自由移动,因而干燥的NaC1晶体不能导电。由于水分子是一端显正电另一端显负电的极性分子,当NaCl固体加到水中时,一 些水分子以它的正极和NaCl晶体表面上的Cl⁻相吸引,另一些水分子则以它们的负极和晶体表面上的Na⁺相吸引。由于水分子的作用,使Na⁺ 和Cl⁻之间的引力削弱,就会脱离晶体表面进入溶液,成为被水分子包围的能够自由移动的水合离子,如图7-2所示。固体氯化钠 在高温下,Na⁺和Cl运动速度加剧。当温度达到NaCl的融点时,Na⁺、Cl⁻具有一定的能量足以使钠离子和氯离子摆脱晶格的固 定排列而成为液体,Na⁺和Cl⁻成为可自由移动的离子。由于NaCI溶液或熔融的NaCl都有可以自由移动的离子,所以在外电场作用下,离子就作定向移动,因而具有导电性。
(2)极性共价键组成的化合物。以HCI为例,当HCI分子溶于水时,同样,HCl分子的两极由于各受水分子中异极的吸引,使氢与氯之间的极性共价键发生了变化,使它们原来共用的一对电子脱离了氢原子而转移到氯原子上,于是就形成了带正电 荷的氢离子( H⁺)和带负电荷的氯离子(Cl⁻)的水合离子,如图7-3所示。所以HCI溶液也能导电。
蔗糖、酒精等非电解质物质的分子与电解质分子的内部结构不同,它们的极性键很弱,溶解于水时,水分子不能把它们分离成离子;因此在这些化合物的溶液中没有离子只有其分子均匀地分散在水中,所以它们的溶液不能导电。
电解质溶于水或受热熔化而离解成自由移动的离子的过程叫做电离(或叫离解)。每种电解质都能电离生成一种带正电荷的正离子(或叫阳离子)和一种带负电荷的负离子(或叫阴离子)。正负离子所带电荷的总和是相等的,所以整个溶液仍保持电中性。
电解质在水溶液中的电离可用电离式表示,例如,
NaCl→Na⁺+Cl⁻
HCI→H⁺+Cl⁻
Ca(OH)₂→Ca²⁺+2OH⁻
应该注意,电离与上章谈的溶解是两个不同的概念,它们之间既有本质区别,又有密切联系。溶解是物质以分子(或离子)形式均匀分散到溶剂中形成溶液的过程。无论是电解质,还是非电解质,在水中或多或少都能溶解。而电离是指物质的分子离解成能自由移动的正、负离子的过程。非电解质虽然能溶解但并不发生电离,只有电解质溶于水时才会发生电离,当然电解质的溶解和电离是同时发生的。
可见溶液中的离子不是由于电流的作用才产生的,而是当电解质溶于水时形成的。溶液通电流时,只是使溶液中的正、负离子分别向阴、阳极作定向移动,从而传导电流。非电解质溶液中没有离子存在,因此不能导电。
二、强电解质和弱电解质
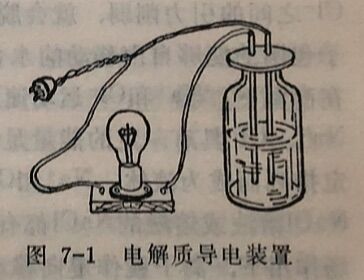
虽然所有电解质溶液都能够导电,但各种不同电解质溶液导电能力的强弱却不一样。利用图7-1的装置,可以粗略地测试溶液导电能力的强弱。
把浓度相同的HCI和NH₃溶液在同一装置中作试验。试验结果表明:当电极插入HCl溶液时,灯泡很亮;而当插入NH₃溶液时,灯泡较暗。灯泡愈亮,溶液通过的电流愈强,溶液的导电性愈好。上述试验也就说明了HCI溶液的导电能力比NH₃溶液的强。
如上所述,溶液的导电是由于其中有离子的缘故。由此可知,溶液导电性的强弱必与溶液单位体积内存在的离子多少有关。一般说来,单位体积内离子越多,其导电能力越强。不同电解质在相同条件(如温度、浓度相同)下,在水中电离的程度是不同的。通常根据电解质电离程度的大小,把电解质分为强电解质和弱电解质两类。具有典型离子键的化合物,如强碱( NaOH和KOH等)、大部分盐类( NaCl和CaCl₂等)和强极性共价键化合物(如HCl等),在极性水分子作用下能够完全电离,这种在水溶液中能够完全电离的电解质称为强电解质。而那些具有弱极性键的化合物,如NH₃、HAc(醋酸)等溶于水时只有部分分子电离,大部分仍是呈分子状态,这种在水溶液中只能部分电离的电解质称为弱电解质。







![硫酸亚铁铵标准溶液c[(NH4)2Fe(SO4)2]厂家价格](images/202207/thumb_img/1630_thumb_G_1658535105210.jpg)








![硫酸铈标准溶液浓度 c[Ce(SO4)2] = 0.1500 mol/L价格](images/202207/thumb_img/1632_thumb_G_1656925752112.jpg)



![硝酸铜标准溶液 c[Cu(NO3)2]= 0.01000 mol/L价格](images/202207/thumb_img/1653_thumb_G_1658537651764.jpg)