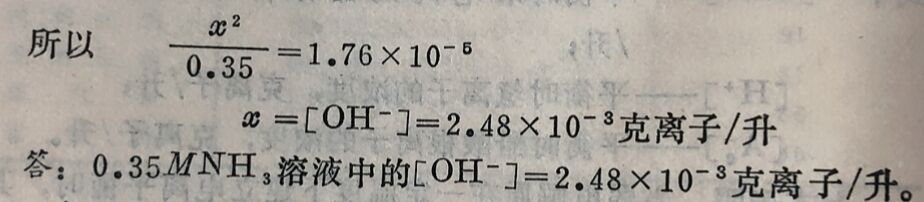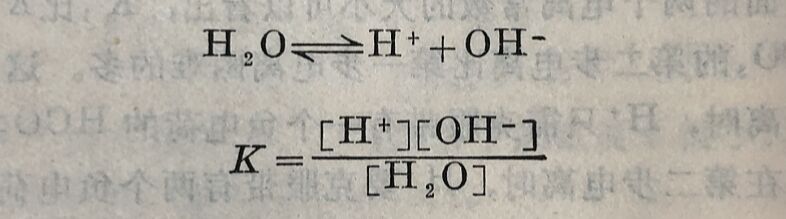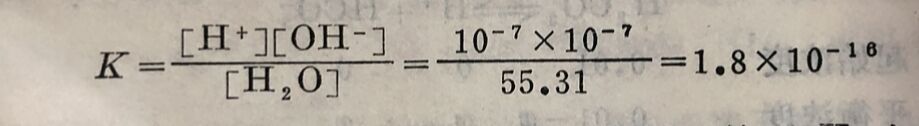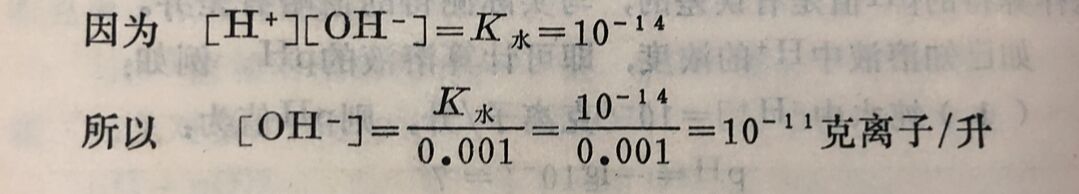如将[H₂O]与K相乘,其乘积一定也是常数,并以K水表示,即:
K水=[H⁺][OH⁻]
上式表明在一定温度下, 水中的H⁺和OH⁻活度(≈浓度) 的乘积是一常数, 这一常数K水叫做水的离子积常数,简称为水的离子积。
根据实验测定,24°C时一升纯水中[H]和[0H-]各有10⁻⁷克离子,则水的离子积为:
K水=[H⁺][OH⁻]=10⁻⁷x10⁻⁷=10⁻¹⁴
K水与其它平衡常数一样,只与温度有关,而与H⁺和OH⁻的浓度无关,如24°C时, K水=1x10⁻¹⁴, [H⁺]= [OH⁻]=10⁻⁷,而在200°C时,K水=5.5×10⁻¹²,[H⁺]=[OH⁻]=2.34x10⁻⁶克离子/升。由于常温时的K水与24°C时的相差不远,所以常温时一般都用K水=10⁻¹⁴。表7-4列出K水与温度的关系。
表7-4 K水与温度的关系
| 温度(°C) |
0 |
10 |
20 |
24 |
30 |
40 |
| K水×10¹⁴ |
0.1133
|
0.2920 |
0.6809 |
1.000 |
1.468 |
2.917 |
| 温度(°C) |
50 |
60 |
80 |
100 |
150 |
200 |
250 |
| K水×10¹⁴ |
5.474 |
9.62 |
25.8 |
51.3 |
234 |
550 |
676 |
在常温下,溶液中的[H⁺]和[OH⁻]不论如何变化,但它们的乘积K水不变,因此,K水不仅反应了纯水中H⁺和OH⁻浓度的关系,而且也反应了水溶液中H⁺和OH⁻浓度的关系。故知道溶溶中[H⁺]和[OH⁻]中的任何一个就可以计算另一个。
纯水中[H⁺]=[OH⁻],在常温下为10⁻⁷克离子/升,所以纯水是显中性的。如在纯水中加入一定量的盐酸,由于[H⁺]增加,则H₂O⇔H⁺+OH⁻平衡就会向左移动,使[OH⁻]相应降低。 例如在纯水中加入盐酸并使HCl的浓度为0.001M ,溶液中的H⁺,应是盐酸和水两者电离生成的H+之和。由于盐酸是强酸,在水中是全部电离的,可近似地用浓度代替活度,那末HCI提供的[H⁺]为0.001克离子/升;而水电离生成的[H⁺],与此值相比是很小的,可以忽略不计;则溶液中[H⁺]即等于0.001克离子/升。
可见,在纯水中加入盐酸成为0.001MHCI后,能使OH⁻浓度由10⁻⁷克离子/升降到10⁻¹¹克离子/升,而耳浓度则由原来的10⁻⁷克离子/升上升到10⁻³克离子/升。因溶液中[H⁺]>[OH⁻],所以溶液显酸性。
反之,在纯水中加入NaOH使之成为0.001M的NaOH,同样可以根据水的离子积求得溶液中[H⁺]=10⁻¹¹克离子/升,而[OH⁻]=10⁻³克离子/升,此时在溶液中,[OH⁻]>[H⁺],所以溶液显碱性。
由以上讨论可知,溶液中总是存在H⁺和OH⁻,只是由于两者浓度大小变化而使溶液呈中性、酸性和碱性。
















































.jpg)