銅的化合物
铜臭 / 2022-08-03
銅形成一价和二价化合物。一般說来,后者較稳定。除CuO及Cu(OH)₂外,二价铜的强酸盐皆溶于水,且在稀溶液中几乎完全电离。水合二价銅离子[Cu(H₂O)₄]⁺⁺呈現天藍色,在水溶液中稍为水解,故溶液略显酸性。
二价銅离子形成貉合物的傾向很大。銅离子在水溶液中就是水合格离子[Cu(H₂O)₄]⁺⁺,屬外軌型絡合物。[Cu(NH₃)₄]⁺⁺、 [CuCl₄]⁻⁻和[Cu(CN)₄]⁻⁻是内軌型络离子,结构为正方形,配位体占用銅的dsp²杂化軌道。
一价化合物如Cu₂O,Cu₂S和簡单盐类几乎都不溶于水。它們都具有一定的共价性,一般共价性愈高,顏色愈深。一价銅的絡离子有[Cu(CN)₄³⁻]-,[CuCl⁴]³⁻等,结构为四面体形。
1.一价鐦化合物
i)氧化物和氢氧化物 含有酒石酸销钾NaKC₄H₄O₆的硫酸銅破溶液用葡萄糖来还原,可制得氧化铜⁽ᴵ⁾Cu₂O,或称氧化亚銅:
2Cu(OH)₂+C₆H₁₂O₆=Cu₂O+2H₂O+C₆H₁₂O₇
由于制备方法和条件的不同,晶粒的大小各异,呈現的顏色也是多样的,如黄、橙黄、鲜紅或深棕色。
Cu₂O几乎不溶于水,但遇稀硫酸,先生成可溶性的硫酸銅”,然后立即歧化为Cu和CuSO₄:
Cu₂O+H₂SO₄=CugSO₄+H₂O
Cu₂SO=CuSO₄+Cu
氧化銅⁽ᴵ⁾溶于氨水或氫卤酸中,分别形成絡合物:
[Cu(NH₃)₂]OH和H[CuX₂]
在一价銅盐的溶液中加入氢氧化纳,有淡黄色的氩氧化銅⁽ᴵ⁾CuOH析出。稍热即脫水成Cu₂O。
(i)卤化物在含有CuSO⁴和KCl的热溶液中,通入二氧化硫使Cu⁺⁺还原为Cu⁺,可得氯化銅⁽ᴵ⁾CuCl沉淀。
2CuSO₄+2KCl+SO₂+2H₂O=2CuCl+2KHSO₄+H₂SO₄
此外,在热的濃盐酸中,用Cu将CuCl₂还原,也可制得CuCl:
Cu+CuCl₂=2CuCl
显而易見,这里的作用是一价銅化合物歧化作用的逆向反应。这反应之所以可能进行完全是由于溶液中的Cu⁺濃度保持很低,不使增高。因为反应是在浪盐酸中进行,生成的CuCl随即与HCI形成絡合物:
CuCl+HCl=H[CuCl₂]
用水稀釋淩盐酸溶波,CuCl即析出。由于CuCl的溶解度很小,故不論是HCuCl₂或CuOl,溶液中Cu⁺的漉度都很小,不致使化合物发生歧化反应。
卤化铜(I)皆溶于氨水而形成[Cu(NH₃)₂]⁺络离子。氯化銅(I)的濃盐酸溶液能吸收-一氧化碳而形成貉合物[Cu(CO)]Cl,在气体分析中,测定CO含量即利用这性质。
2.二价銅化合物
(i)氧化銅和氫氧化銅将 硝酸銅或碳酸铜加热分解,可制备氧化銅CuO。呈黑色,不溶于水,但溶于酸中。氧化銅的热稳定性很高,只有在800°时才开始分解为氧化銅⁽ᴵ⁾和氧。加热时可被氫或氨气还原为銅:
3CuO+2NH₃=N₂+3H₂O+3Cu
在硫酸錒溶液中加入碱,即有淡藍色的氣氧化銅⁽ᴵᴵ⁾Cu(OH)₂析出,加热,即脫水变为黑色氧化銅。氫氧化銅微显两性,既溶于酸,也溶于濃NaOH溶液中,形成銅酸盐Na[Cu(OH)₄]。
氫氧化銅溶解在氨水中,生成深藍色絡合物[Cu(NH₃)₄]⁺⁺:
Cu(OH)₂+4NH₃=[Cu(NH₃)₄](OH)₂
上述溶液具有溶解纖維的性能。在所得纖維溶液中加入水或酸,纖雜又复析出。工业上利用这种性质来制造人造絲。
(i) 卤化銅除CuI₂因为不稳定而不存在外,其它卤化銅都可借助于碳酸銅和氫卤酸的作用而制得。
阴离子变形性依F至Br的順序而增加,銅离子吸引阴寓子的个别电子軌道也愈强烈,因此顏色依次加深:无水氟化銅呈白色,氯化銅棕黄色,澳化铜黑色。X射线的研究结果表明,氟化銅是离子化合物,氯化铜和溴化銅則系共价化合物,结构为链状。
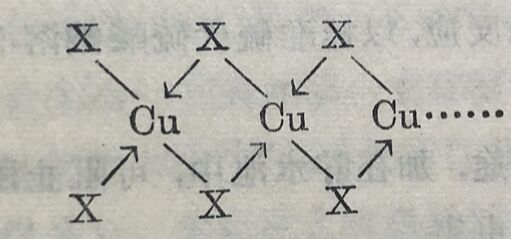
卤化銅和相应的破金属卤化物作用即生成M⁽ᴵ⁾[CuX₃]或M₂⁽ᴵ⁾[CuX₄]型貉盐,和自由氢卤酸作用即生成相应的络酸。
氯化銅在很渡的溶液中呈现黄称色,在濃的溶液中呈現称色, 在稀溶液中呈現藍色,黄色是由于[CuCl₄]⁻⁻絡离子的存在, 而藍色是由于Cu(H₂O)₄⁺⁺絡离子的存在;两者扦存时就显現称色。溴化銅溶液的颜色也有同样的变化。氯化銅和溴化铜都在空气中潮解,不但易溶于水而且易溶于乙醇和丙酮。氯化銅在紅热时,分解为氯化銅⁽ᴵ⁾和氯:
2CuCl₂⇔2CuCl+Cl₂
这个反应在过去曾用以制备氯气。氯化銅的濃溶液可吸收NO,顏色变为棕黑色,当稀釋时,NO又复放出。
(iii)硫酸銅用 热的渡硫酸溶解銅,或者在充足供应空气的条件下,用热的稀硫酸来溶解銅,都可制备五水合硫酸銅,又叫胆矾:
Cu+2H₂SO₄=CuSO₄+2H₂O+SO₂
2Cu+2H₂SO₄+O₂=2CuSO₄+2H₂O
无水硫酸銅是白色粉末,吸水变为藍色。所以CuSO₄常用来檢驗有机液体中的微量水,也可以作为干燥剂。当加热到650°C时,即分解为CuO:
2CuSO₄=2CuO+2SO₂+O₂
将碘化鉀加入硫酸銅溶液中,立即有碘析出:
2CuSO₄+4KI=2CuI+2K₂SO₄+I₂
在分析化学中利用此反应,以标准硫代硫酸鈉溶液滴定碘,就可以定量地測定銅。
硫酸銅有很多用途,加在貯水池中,可阻止藻类的生长;与石灰乳的混合液能消灭虫害。
(iv)硝酸銅把銅溶于硝酸中,程蒸发即有藍色的三水合硝酸銅Cu(NO₃)₂·3H₂O析出。此外,尚有含6个或9个分子水的水合物。把水合硝酸銅脫水,不能得到无水盐,因为在加热到170°时,就产生碱式硝酸銅Cu(NO₃)₂·Cu(OH)₂,进步加热到200°,則分解为CuO。将銅溶解在N₂O₄和醋酸乙酯混合物中,可得结晶Cu(NO₃)₂·N₂O,。将晶体加热到85°C,它即分解为无水硝酸銅。
(v)硫化銅在微酸性的 二价銅盐溶液中通大H₂S,有黑色的硫化銅CuS析出。它不溶于水也不溶于稀酸中,溶度积为8.5×10⁻⁴⁵(18°),只能溶于热的稀硝酸中:
3CuS+2NO₃⁻+8H⁺=3Cu⁺⁺+2NO+3S+4H₂O
或溶于氰化鈉或鉀的溶液中:
2CuS+10CN⁻=2[Cu(CN)₄]³⁻+2S⁻⁻+(ON)₂



















![硝酸铜标准溶液 c[Cu(NO3)2]= 0.01000 mol/L价格](images/202207/thumb_img/1653_thumb_G_1658537651764.jpg)












