鋅
铜臭 / 2022-08-03
一、鋅的存在和冶炼
鋅以化合物的形式广泛地分布于自然界。主要的矿石为閃鋅 矿ZnS和菱鋅矿ZnCO₃。单一的鋅矿不多,大多与鉛共生。
鉛鋅矿內鋅的含量很低,须用浮选法将它澳缩成为含有40-60%ZnS的精矿。将精矿焙烧便共鸭化为氧化鋅,再把氧化锋与 无姻煤混合,在蒸餾罐中加热至1200-1300°使氧化鋅还原为辞,
2ZnS+3O₂=2ZnO+2SO₂
ZnO+CO=Zn+CO₂
然后蒸佃分出。粗鋅的纯度一般为98%,其中主要杂质为铅、鎘和铁。用其空蒸馏法可制纯鋅。如果用电解法炼鋅,先在800°左右氯化焙燒ZnS精矿,大部分变为硫酸鋅,小部分变为氧化鋅:
ZnS+2O₂=ZnSO₄
2ZnS+3O₂=2ZnO+2SO₂
所得产物用碗酸溶解,使氧化鋅也变为硫酸锌:
ZnO+H₂SO₄=ZnSO₄+H₂O
在硫酸鋅溶液中加入鋅粉,将鎘、鈷、鎳、銅和銀等杂质置换出去,然后将溶液置于电解槽中,在阴极上析出的鋅其純度为99.5%。
二、鋅的性质与用途
鋅是銀白色金属,略带藍色,在常溫下性脆,加热至100-150°时,呈展性,在200°以上,又变脆甚至可压成粉末。它与許多金厨 形成合金,重要的有黄銅(Cu 67%,Zn 33%)和鋁黃銅(Zn 85%, Al 5%,Cu 10%)。
鋅与含有CO₂的潮湿空气接触,可生成碱式碳酸盐:
4Zn+2O₂+3H₂O+CO₂=ZnCO₃·3Zn(OH)₂
当加热到1000°,鋅即在空气中燃燒,并发出明亮的蓝綠色火焰,而形成氧化鋅ZnO。在紅热状态时,可为水蒸汽或二氧化碳所氧化:
Zn+H₂O=ZnO+H₂
Zn+CO₂=ZnO+CO
在普通条件下,鋅与卤案作用報慢。把鋅粉与硫共热可形成硫化鋅ZnS。在600°,通氦于鋅粉上,即有灰色的氮化鋅Zn₃N₂生成:
3Zn+2NH₃=Zn₃N₂+3H₂
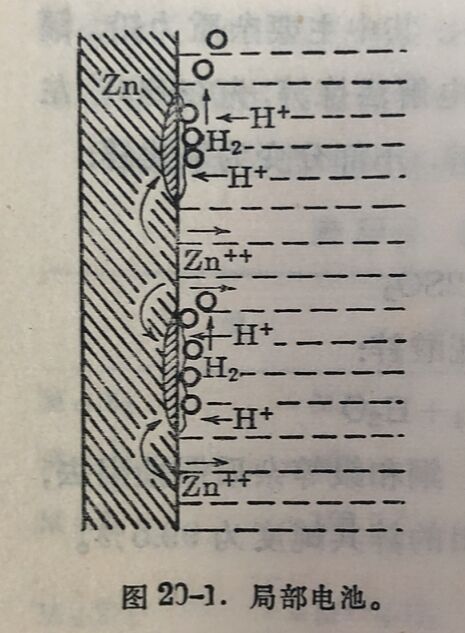
纯鋅不易与酸反应而釋出氣。含有杂质的鋅才与酸迅速作用,因鋅舍有杂质,在稀酸中即形成局部电池。杂质是阳极而鋅是阴极。鋅溶于酸中而将电子轉移至阳极使H+放电而釋出氫气(見图20-1)。如果是純鋅,放出的微量氢气复盖在鋅的表面上,阻止表面与酸接触,反应因而停頓。为了使純鋅在稀酸中溶解迅速,在酸中加大几滴硫酸铜,銅被鋅置换出来,镀在鋅上,从而形成局部电池,氫离子在銅上放电而逸出,鋅即可迅速溶解。
鋅的表面容易产生碱式碳酸盐薄膜。鋅也比铁活潑,故在铁板上常鍍鋅以防止生绣。如鋅被损坏,則形成局部电池,铁是阳极,鋅是阴极,电子从鋅轉移到铁,因此铁不会遭到腐蝕。
鋅不管是純或不純,都溶解于硝酸中。由于酸的濃度和反应温度不同,反应的产物也各不相同。鋅既溶解于强碱中(与鈹和鋁相同),也溶解于氨水中(与皱和鋁不同):
Zn+2H₂O+2NaOH=Na[Zn(OH)₄]+H₂
Zn+2H₂O+4NH₃=[Zn(NH₃)₄](OH)₂+H₂
因为鋅粉是很强的还原剂,故用于有机合成、染料制备以及金和银的冶炼。


































![双[2-(2-苯并噻唑基)苯酚]锌CAS号58280-31-2](images/202103/thumb_img/3471_thumb_G_1616030551385.jpg)