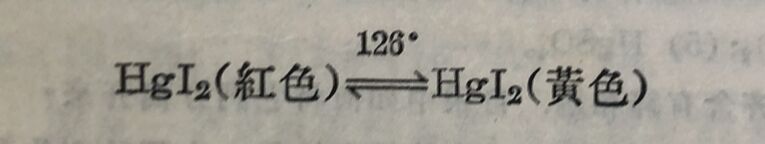在卤化汞⁽ᴵ⁾中最重要的是Hg₂Cl₂,俗称甘汞。 在氯化汞⁽ᴵᴵ⁾的溶液中通入二氧化碗,或将汞和氯化汞⁽ᴵᴵ⁾在一起研磨,均可制得甘汞:
2HgCl₂+SO₄+2H₂O=Hg₂Cl₂+H₂SO₄+2HCl
HgCl₂+Hg=Hg₂Cl₂
少量的甘汞无毒,在医药上用做泻剂。如果用氨水处理甘汞,则上面的反区应就反向进行,即一价录歧化为二价汞和金属汞:
Hg₂Cl₂+2NH₃=Hg+HgNH₂Cl↓+NH₄⁺+Cl⁻
HgNH₂CI原是白色沉淀,因其中混有很網的金屬汞珠,故显黑色。这个反应在分析化学中用来检验Hg₂⁺⁺离子。
2.二价化合物
二价汞的强酸盐大多数呈无色,而弱酸的汞盐則带有颜色,如亚硝酸汞⁽ᴵᴵ⁾为黄色,正砷酸汞⁽ᴵᴵ⁾为柠檬色等。硫酸汞⁽ᴵᴵ⁾、硝酸汞田和高氯酸汞⁽ᴵᴵ⁾易溶于水,在水中电离而且水解,水解度比一价汞盐高,故溶液显强酸性。有些二价汞盐如氯化物、溴化物和氰化物等虽然也易溶于水,但电离度很低,水解度也比較小。許多汞⁽ᴵᴵ⁾盐在有机溶剂如乙醇、乙醚等中的溶解度很高。二价汞离子形成络合离子的倾向很强,络离子的稳定性高。
(i)氧化汞⁽ᴵᴵ⁾ 把硝酸汞⁽ᴵᴵ⁾徐徐加热,得到的是紅色氧化汞⁽ᴵᴵ⁾HgO。
2Hg(NO₃)₂=2HgO+4NO₂+O₂
如果在硝酸汞⁽ᴵᴵ⁾溶液中加入强碱,也可以制得氧化汞⁽ᴵᴵ⁾,不过产物是黄色:
Hg(NO₃)₂+2NaOH=2NaNO₃+HgO+H₂O
用X射线研究二种不同顏色的HgO的结果表明,二者的晶体结构并无区别,顏色的不同是由晶粒大小不同所致。但某些物理性质是有差异的,例如紅色氧化汞⁽ᴵᴵ⁾的密度为11.9,黄色的为11.24;在18°时的溶解度,前者为51.5毫克/升,后者为52.0亳克/升。氧化汞⁽ᴵᴵ⁾在水中略显碱性反应:
HgO+H₂O=Hg⁺⁺+2OH⁻
氧化汞⁽ᴵᴵ⁾在300° 以上分解为氧和汞。与氨水作用形成的 2HgO·NH₄OH,加热失水后会爆炸。氧化汞⁽ᴵᴵ⁾用于制备濃的次氯酸容液和各种汞的化合物。氫氧化汞⁽ᴵᴵ⁾不稳定,因而不能制备。
(ii)卤化汞⁽ᴵᴵ⁾ 在氟气中把 HgF加热到275°,可制得无水氟化汞⁽ᴵᴵ⁾HgF₂。其他的卤化物可用汞⁽ᴵᴵ⁾盐与适量的碱金局卤化物在溶液中作用而制得。
卤化汞中,除碘化汞⁽ᴵᴵ⁾是黄色,其余的都是白色(表20-9)。氧化汞的熔、沸点較高,屬离子型化合物,不溶于有机溶剂,在水中发生水解作用。相万地,氯化汞⁽ᴵᴵ⁾、溴化汞⁽ᴵᴵ⁾和碘化汞⁽ᴵᴵ⁾的熔、沸点比較低,微溶于水,但易这于有机溶剂中,故为共价化合物。卤化汞⁽ᴵᴵ⁾与碱金局卤化物形成M⁽ᴵ⁾[HgX₃]型和M₂ᴵ[HgX₄]型络合物,稳定性依Cl-Br-I 順序增高。
表20-9 卤化汞⁽ᴵᴵ⁾的性质
| 性质 |
HgF₂
|
HgCl₂
|
HgBr₂
|
HgI₂
|
|
颜色
熔点,°C
沸点,°C
18°C溶解度,克分子/升
键性:
离子间距离,Å
原子间距离,Å
实验数值,Å
生成热,千卡/克分子
水合物,水分子数
|
白
645
650
水解
2.46
2.14
2.40
—
2
|
白
276
302
0.3
2.91
2.47
2.25
53.43
—
|
白
236
322
0.017
3.05
2.62
2.48
41.58
—
|
黄
259
354
1.3×10⁻⁴
3.26
2.81
2.78
25.33
22.2
—
|
氯化汞⁽ᴵᴵ⁾俗称升汞,有剧毒, 在外科上用做消毒剂。它略溶于水,电离度比氯化鎘还低,在溶液中略有水解作用:
HgCl₂+H₂O=Hg(OH)Cl+Cl⁻+H⁺
在酸性溶液中,适量的氯化錫⁽ᴵᴵ⁾将它还原为氯化汞⁽ᴵ⁾:
2HgCl₂+SnCl₂+2HCl=Hg₂Cl₂↓+H₂SnCl₆
如果用过量的二氯化錫,生成的氯化汞”可进一步还原为Hg:
Hg₂Cl₂+SnCl₂+2HCl=2Hg+H₂SnCl₆
利用上述的反应在分析化学中可檢驗Hg⁺⁺离子。
氯化汞⁽ᴵᴵ⁾溶液用过量的氨水处理,則得白色沉淀氯化氨基汞⁽ᴵᴵ⁾Hg(NH₂)Cl:
HgCl₂+2NH₃=Hg(NH₂)Cl+NH₄Cl
它加热即分解为Hg₂Cl₂、NH₃、N₂,而不熔化,故称为“不熔性白色沉淀”。若氯化汞⁽ᴵᴵ⁾溶液中 含有大量的氯化銨,以氨水处理,則得白色结晶沉淀,氯化二氨合汞⁽ᴵᴵ⁾,Hg(NH₃)₂Cl₂。它加热即熔化,但不分解,故称为“可熔性白色沉淀”。
碘化汞⁽ᴵᴵ⁾有两种结晶构型,种是紅色, 另一种是黄色,它們的轉变溫度为126°C:
它溶于过量的碘化鉀容液中,形成K₂HgI₄,加入氫氧化鉀使呈碱性,所得溶液称为奈斯勒(Nessler)試剂,用以檢驗氨,因微量的氨就可使溶液显黄色或产生黄色沉淀:
2K₂[HgI₄]+NH₃+3KOH=(HO)Hg(NH)HgI+7KI+2H₂O
(iii)硫化汞⁽ᴵᴵ⁾硫化汞有两种结晶构型,一种是黑色的,另一种是紅色的。在自然界存在的辰砂是紅色的。通硫化氫于酸性的汞⁽ᴵᴵ⁾盐溶液中,得黑色硫化汞⁽ᴵᴵ⁾。黑色变体加热至386°,可轉变为較稳定的紅色变体。硫化汞四在金屬硫化物中溶解度是最小的,溶度积为2x10⁻⁴⁹(18°)虽然在热的渡硝酸中也不易溶,但溶于王水中:
3HgS+12HCl+2HNO₃=3[HgCl₄]⁻⁻+6H⁺+3S+2NO+4H₂O
(iv)汞的其他化合物 将氧化汞⁽ᴵᴵ⁾溶于硫酸中得无水硫酸汞⁽ᴵᴵ⁾HgSO₄。它微溶于水,在溶液中发生水解作用,形成黄色 2HgO·HgSC₄,加热即分解为Hg、SO₂和O₂。在有机合成里,硫酸汞是一种重要的催化剂。
在过量的硝酸中溶解汞則生成硝酸汞⁽ᴵᴵ⁾:
3Hg+8HNO₃=3Hg(NO₃)₂+2NO+4H₂O
最常見的水合物是Hg(NO₃)₂·H₂O。硝酸汞溶于水,发生强烈的水解作用,形成碱式盐HgO·Hg(NO₃)₂。