
































表17-1和17-2列举了碱金属和碱土金属的一些重要性质。
碱金属元素原子的价电子层结构为ns1。因此,碱金属元素只有+Ⅰ氧化态。碱金属原子最外层只有一个电子,次外层为8电子(Li为2电子),对核电荷的屏蔽效应较强,所以这一个价电子离核较远,特別容易失去,因此,各周期元素的第一电离势以碱金属为最低。与同周期的元素比较,碱金属原子体积最大,在固体中原子间的引力较小(因每个原子只有一个电子参加金属键),所以它们的熔点,沸点、硬度、升华热都很低,并随着Li-Na-K-Rb-Cs的顺序而下降。随着原子量的增加(即原子半径增加),电离势和电负性也依次降低,见表17-1。
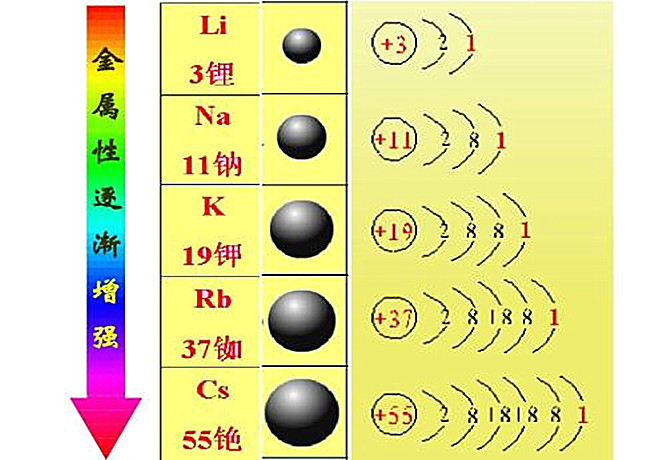
表17-1 碱金元素的基本性质
|
元素 性质 |
锂 | 钠 | 钾 | 铷 | 铯 |
| 符号 | Li | Na | K | Rb | Cs |
| 原子序 | 3 | 11 | 19 | 37 | 55 |
| 原子量 | 6.941 | 22.9893 | 39.098 | 85.4678 | 132.9054 |
| 价电子层结构 | 2s1 | 3s1 | 4s1 | 5s1 | 6s1 |
| 主要氧化数 | +Ⅰ | +Ⅰ | +Ⅰ | +Ⅰ | +Ⅰ |
| 原子半径/pm*(金属半径) | 152 | 153.7 | 227.2 | 247.5 | 265.4 |
| 离子半径/pm | 68 | 97 | 133 | 147 | 167 |
|
电离势 第一电离势/(kJ·mol-1) 第二电离势/(kJ·mol-1) |
521 7295 |
499 4591 |
421 3088 |
405 2675 |
371 2436 |
| 电负性 | 0.98 | 0.93 | 0.82 | 0.82 | 0.79 |
|
标准电极电势/V M+(aq)+e-=M(s) |
-2.045
|
-2.7109
|
-2.923
|
-2.925
|
-2.923
|
* 表中所列原子半径数值系金属半径值。
表17-2 碱土金属元素的基本性质
|
元素 性质 |
铍 | 镁 | 钙 | 锶 | 钡 |
| 符号 | Be | Mg | Ca | Sr | Ba |
| 原子序 | 4 | 12 | 20 | 38 | 56 |
| 原子量 | 9.01218 | 24.305 | 40.078 | 87.62 | 137.33 |
| 价电子层结构 | 2s2 | 3s2 | 4s2 | 5s2 | 6s2 |
| 主要氧化数 | +Ⅱ | +Ⅱ | +Ⅱ | +Ⅱ | +Ⅱ |
| 原子半径/pm(金属半径) | 111.3 | 160 | 197.3 | 215.1 | 217.3 |
| 离子半径/pm | 35 | 66 | 99 | 112 | 134 |
|
电离势 第一电离势/(kJ·mol-1) 第二电离势/(kJ·mol-1) 第三电离势/(kJ·mol-1) |
905 1768 14939 |
742 1460 7658 |
593 1152 4942 |
552 1070 4351 |
564 971 3575 |
| 电负性 | 1.57 | 1.31 | 1.00 | 0.95 | 0.89 |
|
标准电极电势/V M2++2e- ⇋M(s) M2+(OH)2+2e- ⇋M(s)+2OH- |
-1.85 -2.28 |
-2.375 -2.69 |
-2.76 -3.02 |
-2.89 -2.99 |
-2.90 -2.97 |
碱金属性质的变化一般很有规律,但由于锂原子最小,所以有些性质表现特殊。事实上,除了它们的氧化数以外,锂及其化合物的性质与本族其它碱金属差别较大,而与周期表中锂的右下角元素镁有很多相似之处。

碱金属元素在化合时,多以形成离子键为特征,但在某些情况下也显共价性。气态双原子分子,如Na2、Cs2等就是以共价键结合的。碱金属元素形成化合物时,锂的共价倾向最大,铯最小。
与碱金属元素比较,碱土金属最外层有2个s电子。次外层电子数目和排列与相邻的碱金属元素是相同的。由于核电荷相应增加了一个单位,对电子的引力要强一些,所以碱土金属的原子半径比相邻的碱金属要小些,电离势要大些,较难失去第一个价电子。失去第二个价电子的电离势约为第一电离势的一倍。从表面上看碱土金属要失去两个电子而形成二价正离子似乎很困难,实际上生成化合物时所释放的晶格能足以使它们失去第二个电子。它们的第三电离势约为第二电离势的4~8倍,要失去第三个电子很困难,因此,它们的主要氧化数是+Ⅱ而不是+Ⅰ和+Ⅲ。由于上述原因,所以碱土金属的金属活泼性不如碱金属。比较它们的标准电极电势数值,也可以得到同样的结论。
在这两族元素中,它们的原子半径和核电荷都由上而下逐新增大;在这里,原子半径的影响是主要的,核对外层电子的引力逐渐减弱,失去电子的倾向逐新增大,所以它们的金属活泼性由上而下逐渐增强。
碱金属和碱土金属固体均为金属晶格,碱土金属由于核外有2个s电子,原子间距离较小,自由电子活动性较差。因此,它们的熔点、沸点和硬度均较碱金属高,导电性却低于碱金属。碱土金属的物理性质变化不如碱金属那么有规律,这是由于碱土金属晶格类型不是完全相同的缘故。碱金属皆为体心立方晶格,碱土金属中,Be、Mg为六方晶格,Ca,Sr为面心立方晶格,Ba为体心立方晶格。
该两族元素的离子还有各自的不同的味道特性,如Li+离子味甜;K+、Na+离子味咸;Ba+离子味苦。
Li+离子的极化力是碱金属中最强的,它溶剂化作用和形成共价的趋势异常的大。有人提出有“锂键”的存在。类似于氢键,如H—F···Li—F和(LiF2)2。
更多相关文章请查看下方网址浏览
碱金属和碱土金属的过氧化物https://www.999gou.cn/article.php?id=2233
碱金属和碱土金属的普通氧化物https://www.999gou.cn/article.php?id=2232
碱金属和碱土金属单质的化学性质https://www.999gou.cn/article.php?id=2231
碱金属和碱土金属单质的物理性质https://www.999gou.cn/article.php?id=2230
碱金属和碱土金属单质的制备方法https://www.999gou.cn/article.php?id=2229
碱金属和碱土金属的通性https://www.999gou.cn/article.php?id=2228