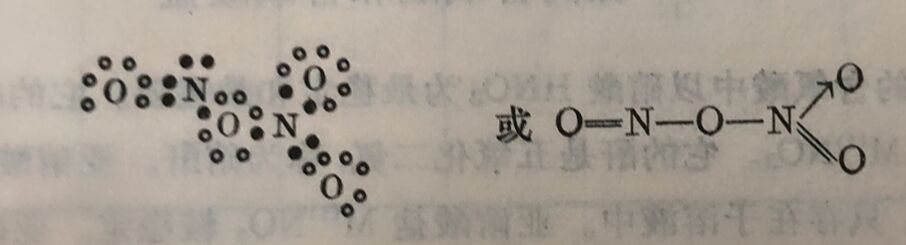
三氧化二氮N₂O₃
铜臭 / 2022-07-26
逐滴加硝酸于三氧化二砷或硝酸与淀粉共热即产生三氧化二氮:
2HNO₃+As₂O₃=2HAsO₃+ N₂O₃
这种氧化物只在固态时稳定。在液态时即部分分解为氧化氮和二氧化氮:
N₂O₃⇔NO+NO₂ Q=-10千卡
在平常情况下,为气态,大部分分解; 在25°C时,未分解的仅为10%。由于上式所表示的反应是可逆的,等体积的NO和NO₂的 混合气体与化合物N₂O₃有完全相同的性质。冷却到-20°C, 三氧化二氮即凝为深藍色液体,在-103°C凝为藍色固体。它溶于碱液内而形成亚硝酸盐:
N₂O₃+2NaOH=2NaNO₂+H₂O
它与水起反应后的主要产物是亚硝酸:
N₂O₃+H₂O=2HNO₂
因此,三氧化二氮是亚硝酸的酐,故称为亚硝酐。不过,自由的亚硝酸也不稳定,很快地分解而产生硝酸:
3HNO₂=HNO₃+2NO+H₂O
三氧化二氮的结构式为
4.二氧化氮NO2
在討論氧化氮时已經指出,如何由該化合物产生二氧化氮。小量制备二氧化氮的最簡便的方法是,加热干燥的硝酸鉛。其反应为
2Pb(NO₃)₂=2PbO+4NO₂+O₂
它是棕紅色的气体,具有特殊臭味并有毒。在22.4°C时凝为紅棕色液体,可以与氧分开。在冶却时液体二氧化氮顏色逐渐变淡,最后变为无色,在-11.2°C结为无色晶体。另一方面,加热气体时,顏色逐漸变深。共蒸气密度的測定证明顏色的改变是由于二氧化氮在冶却时聚合成四氧化二氮N₂O₄之故:
2NO₂⇔N₂O₄ Q=14.7千卡
这个反应的平衡决定于温度。在140°C时,气体全部为NO₂。在較低温度时,平衡中气体的离解部分表示于图13-3。因为二氧化氮是有色的,所以由混合气体颜色的深浅可以看出离解部分的多寡。加热超过150°C,二氧化氮即发生热分解。
2NO₂⇔2NO+O₂
对这个反应平衡所作的研究表明,在600°C以上,分解儿近完全。以上两种分解作用可以简式表示如下:
二氧化氮与水反应形成硝酸和亚硝酐,后者再与水反应生成硝酸和氧化氮,故总反应可以下式表示:
3NO₂+H₂O=2HNO₃+NO
若有空气存在,所生成的NO随即氧化为NO₂,与水反应,最后皆完全变为硝酸。二氧化氮与苛性碱作用而生成硝酸与亚硝酸盐的混合物:
2NO₂+2NaOH=NaNO₃+NaNO₂+H₂O
二氧化氮是强氧化剂。由它的电偶电位可見,它的氧化力与溴相似,
N₂O₄+2H⁺+2e=2HNO₂ E⁰=1.07伏
N₂O₄+4H⁺+4e=2NO+2H₂O E⁰=1.03伏
其作用比硝酸强烈。因此,它被用于鉛室法来制造硫酸。从它和硝酸电偶电位看,
2NO₃⁻+4H⁺+2e=N₂O₄+2H₂O E⁰=0.81 伏
它也是和缓的还原剂,可以为像高錳酸这样的强氧化剂所氧化。
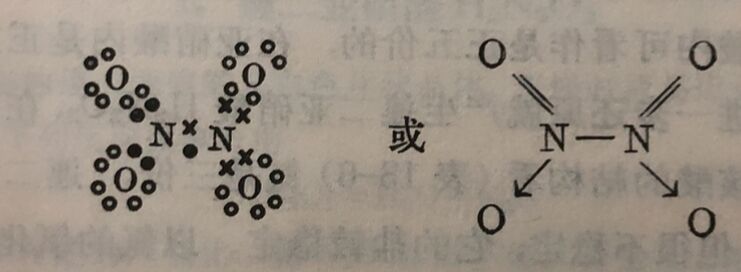
二氧化氮的分子呈角形并有一个三电子键,结构式可写如下式:
O—N—O鍵角为132±2°,N—O鍵长1.20Å。 根据化学性质,四氧化二氮好像是硝酐和亚硝酐的混合体,所以它的结构式似为
但根据物理性质的研究结果,表明它具有对称的精构:






![1,8-二氮杂二环[5.4.0]十一碳-7-烯](images/201812/thumb_img/1103_thumb_G_1545291985569.jpg)







































![1,5-二氮杂双环[4.3.0]壬-5-烯 DBN](images/202306/thumb_img/5107_thumb_G_1688093666688.jpg)




.jpg)
.jpg)
.jpg)
.jpg)