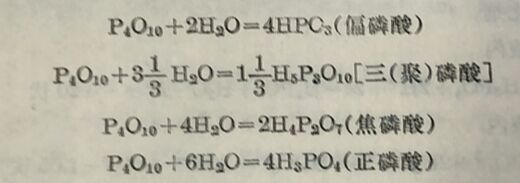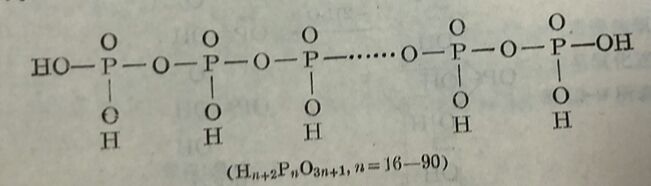磷的含氧酸和含氧酸盐
铜臭 / 2022-07-27
与硫相同,除去由酸酐所生成的酸而外,磷有好几种含氧酸,有的可以自由状态存在,有的只以盐的状态存在。表13-9列出已。知的磷的含氧酸,但不包括它們的聚合体。本节将討論共中較重要的几种。
1.次磷酸H₃PO₂
自由状态的大磷酸是无色晶体,其熔点为26.5°C。虽然次磷酸的分子含 有三个氢原子,但是从它的性质来看,它是一元酸。 因此它的结构是如表13-9所列。
X-射裁对于它的结晶盐的研究也证明H₂PO₂⁻离子的秸构是四面体形,其中两个氨是直接与磷相速接的。
在水溶液内,次磷酸是中强酸,Ka=10⁻², 它的盐皆溶于水。和大多数 中間氧化态的化合物一样, 加热时,純净的次磷酸和它的盐皆分解生成磷元素最高价和最低价的化合物(歧化作用):
4H₃PO₂=2PH₃+2H₃PO₄
实际上,分解作用不完全依照上式进行,还产生少量其他中問氧化态的产物,如P₂H₄、P、H₃PO₃等。由下列几个电偶电位可見次磷酸和它的盐是强的还原剂和弱的氧化剂:
在酸溶液内
H₃PO₃+2H⁺+2e=H₃PO₂+H₂O E⁰=-0.59伏
H₃PO₂+H⁺+e=P+2H₂O E⁰=-0.29伏
在碱溶液内
HPO₃⁻+2H₂O+2e=H₂PO₂⁻+3OH⁻ E⁰=-1.65伏
H₂PO₂⁻+e= P+2OH⁻ E⁰=-1.82伏
虽然有许多氧化剂(如卤素和重金屬离子)足以使次磷酸氧化,但作用有时很慢。叉由于亚磷酸也是还原剂,强氧化剂常使次磷酸直接变为磷酸。次磷酸的盐可由白磷与强碱作用而同膦一起生成:
4P+3KOH+3H₂O=PH₃+3KH₂PO₂
在次磷酸银的溶液中,用硫酸使俱离子沉淀,則得自由状态的次磷酸。
2.亚磷酸HPO₂、H₄P₂O₅、H₃PO₃
虽然偏亚磷酸和焦亚磷酸和它們的盐皆經制得,但只有正亚磷酸为最重要。在水溶液内,偏酸和焦酸皆很快地水化而轉变为正酸。正亚磷酸平常就称亚磷酸。冷水与三氧化二磷作用,或磷与溴水同煮,或三氯化磷水解皆能生成亚磷酸:
PCl₃+H₂O=3HCI+H₃PO₃
自由状态的亚磷酸是无色精品,熔点約74°C, 易溶于水。在水溶液内,亚磷酸是中强的二元酸,K₁=10⁻², K₂=2x10⁻⁷。它的化学性质告证明,在它分子内有一个氧是与P直接相精合的,因此,它有如表13-9所示的秸构式。不过由亚磷酸从三氯化磷的水解而生成的作用和它的若干有机行生物来看,亚磷酸分子可能有另-种秸构,并与第一种秸构呈下列平衡:
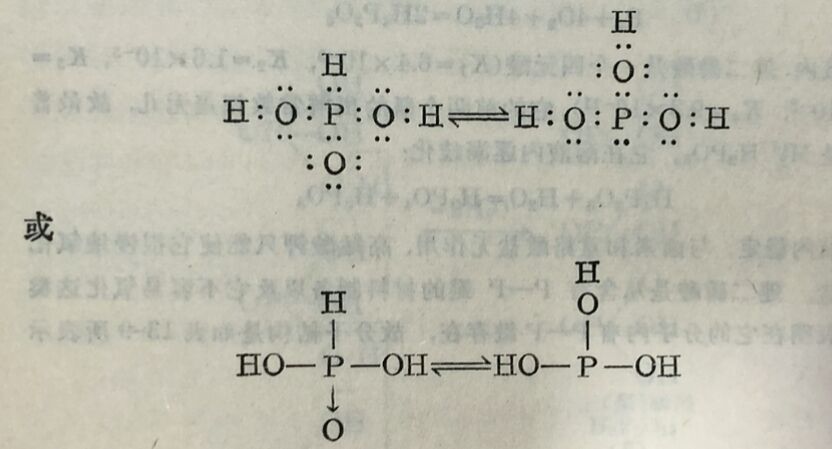
这种平衡在平常情况下几乎至部位移在二元酸状态方面。
自由状态的酸于干热时即分解为膦和磷酸(歧化作用):
4H₃PO₃=PH₃+ ~3H₃PO₄
上节所論以及下列各电偶电位皆表明亚磷酸是一个强的还原剂和弱的氧化剂。
在酸溶液内
H₃PO₄+2H⁺+2e=H₃PO₃+H₂O E⁰=-0.20伏
在碱溶液内
PO₄⁻³+2H₂O+2e=HPO₃⁻⁻+3OH⁻ E°=-1.05伏
亚磷酸及亚磷酸盐与卤素、重鉻酸盐、过二硫酸等氧化剂的反应一般进行很慢,特别在平常温度时。
亚磷酸既为二元酸,故可生成两粗盐,即亚磷酸盐M₂'HPO₃和亚磷酸氫盐M'H₂PO₃。前者的一个氫不能为金属所取代。碱金属和鈣的亚磷酸盐皆易溶于水,其他金屬盐皆难溶。
3.連二磷酸H₄P₂O₆
磷在潮湿的空气中稷慢地氧化,除形成磷酸和亚磷酸外,还产生連二磷酸:
P₄+4O₂+4H₂O=2H₄P₂O₆
在水溶液内,連二磷酸是一个四元酸(K₁=6.4x10⁻³, K₂=1.6x10⁻³, K₃= =5.4x10⁺⁸, K₄=9.3 x10⁻¹¹),它的前两个氩的离解常数相差无几,故最普通的盐是M₂'H₂PO₆。它在溶液内逐渐歧化:
H₄P₂O₆+H₂O=H₃PO₄+H₃PO₃
盐在溶液内稳定,与卤案和重鉻酸盐无作用,高錳酸鉀只能使它很慢地氧化为磷酸盐。連二磷酸是从含有P-P鍵的材料制备以及它不容易氧化这类 性质都表明在它的分子内有P—P键存在,故分子秸构是如表13-9所表示
4.磷酸HPO₃、H₅P₃O₁₀、H₄P₂O₇、H₃PO₄
磷的含氧酸中以磷酸为最稳定。磷也是以磷酸盐的形式存在 于自然界中。P₄O₁₀与水相作用时,即与水化合,根据加合的水分子数目,可以生成下列几种主要的含氧酸:
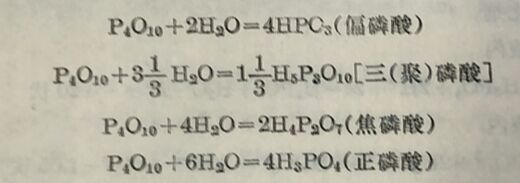
(i)磷酸和多磷酸从 上面的对照可以看出,正磷酸含水最多,它通常簡称为磷酸。磷酸或其适当的酸式盐在强热时就脱水而生成焦磷酸、三磷酸和偏磷酸等,其作用可以下列結构式表之:
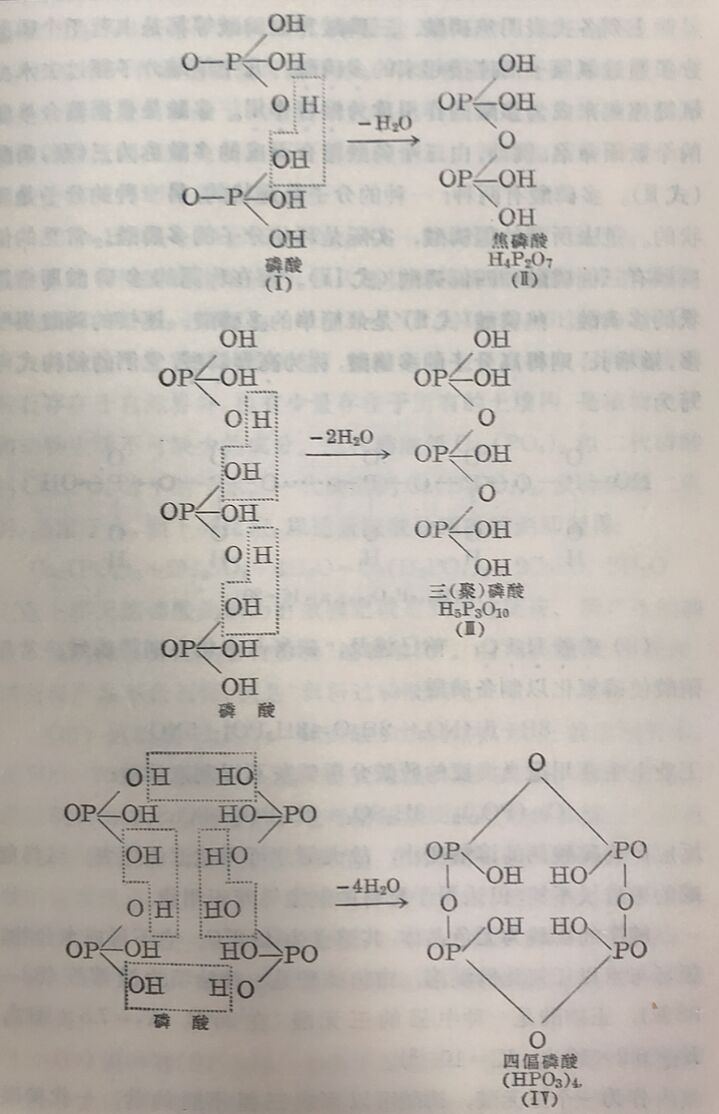
上列各式表明焦磷酸、三磷酸和偏磷酸等都是由若千个磷酸分子通过氧原子而連接起来的多磷酸。几个单酸分子糶过去水由氧鍵連起来成为多酸的作用称为粮合作用。多酸是根据箱合单酸的个数而命名,例如,由三个磷酸缩合而成的多酸称为三(聚)磷酸(式Ⅲ)。多磷酸有两种:一种的分子是鏈状的,另一种的分子是环状的。过去所謂的偏磷酸,实际是环状分子的多磷酸。常見的偏磷酸有三偏磷酸和四偏磷酸(式IV)。現在称謂的多磷酸即指鏈状的多磷酸。焦磷酸(式Ⅱ)是最簡单的多磷酸。連接的磷酸根增多,鏈增长,則得高分子的多磷酸,称为高聚磷酸,它們的秸构式可写为
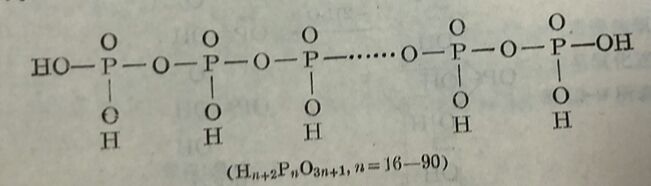
(ii)磷酸H₃PO₄前已述及, 磷酐与水化合則得磷酸。常用硝酸使磷氧化以制备磷酸:
3P+5HNO₃+ 2H₂O=3H₃PO₄+5NO
工业上主要用适当漉度的硫酸分解磷灰石以制取磷酸:
Ca₃(PO₄)₂+3H₂SO₄=2H₃PO₄+3CaSO₄
反应产物硫酸鈣的溶解度小,故大部分可用过滤法除去。这样制成的磷酸很不钝,但适用于肥料的制造等若干用途。
钝泽的磷酸为无色晶体,共熔点为42.8°C。它不形成水合物,但可与水以任何比例混溶,市售磷酸是一种粘稠的濃溶液(83-98%),正磷酸是种中强的三元酸 (在25°C, K₁=7.5X 10⁻³, K₂=6.2x10⁻⁸, K₃=10⁻¹²)。
作为一个三元酸,磷酸可以形成三粗不同的盐。一代磷酸盐M'H₂PO₄皆溶于水。二代磷酸盐M'₂HPO₄和三代磷酸盐M'₃PO₄中只有碱金屬盐可溶于水。平常制备碱金屬磷酸盐的方法是加适当量的磷酸于碱金屬的氫氧化物或碳酸盐的溶液内。不溶性磷酸盐則用复分解法从可溶性盐制取。例如加硝酸銀于任何磷酸盐溶液内即得磷酸銀沉淀:
2Na₂HPO₄+3AgNO₃=Ag₃PO₄+3NaNO₃+ NaH₂PO₄
在含氨的中性磷酸盐溶液内,加大鎂盐則得磷酸鎂銨的难溶晶体:
Na₂HPO₄+NH₃+MgCl₂+6H₂O= (NH₄)MgPO₄·6H₂O+ 2NaCl
磷酸盐中最重要的是鈣盐。磷酸鈣除大量以磷灰石和纖核磷灰石存在于自然界外,也有少量存在于所有的土壤内,是植物生长和动物生活不可缺少的成分。三代磷酸鈣Ca₃(PO₄)₂和二代磷酸 鈣CaHPO₄皆不溶于水。一代磷酸鈣Ca(H₂PO₄)₂, 或称磷酸二氢鈣,易溶于水,照下列反应,以适量硫酸处理磷酸鈣即制得:
Ca₃(PO₄)₂+2H₂SO₄+4H₂O=Ca(H₂PO₄)₂+ 2CaSO₄·2H₂O
工业上将天然磷酸鈣制为有效磷肥就是利用这反应,所产生的磷酸二氫鈣和石膏的混合物称为“过磷酸鈣”。若用磷酸代替硫酸,則所得产品不含石膏,而是“双料过磷酸鈣”。