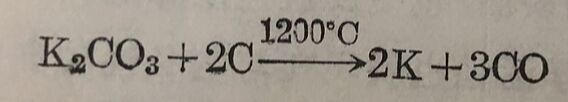碱金屬的存在和提炼
铜臭 / 2022-08-02
一、碱金屬的存在和提炼
在分布极广的天然硅酸盐中,有鉀和钠,如鉀长石K[AISi₃O₈]和鈉长石Na[AlSi₃O₈]。有些盐湖含有氯化鉀。植物灰也是提取鉀盐的重要来源。鉀盐的另一资源是明矾石,从其中不但可提炼鉀且副产品可以綜合利用。海水中氯化纳的含量为2.7%。鋰的重要矿石是鋰焊石LiAl(SiO₃)₂和鋰云母 Li₂(F, OH)₂Al₂(SiO₃)₃,銣和銫常以微量杂质的形式分散于光卤石KCl·MgCl₂·6H₂O和鋰云母中。
制备碱金属的一般方法有二: (i)电解熔融的氯化物或氢氧化物; (i)真空还原碱金属卤化物或碳酸盐。现代制备鋰和钢是用(i)法。从矿石中提取金屬鋰首先须分离鲤的化合物。在高温下,将鋰輝石和硫酸鉀一起燒秸,反应为:
2LiAl(SiO₃)₂+K₂SO₄=Li₂SO₄+K₂O·Al₂O₃·4SiO₂
用水浸取燒秸物并过滤。从滤液中除去鋁和铁后,加入饱和碳酸鈉溶液使Li₂CO₃析出。将碳酸鋰用盐酸轉化为氯化鋰再进行熔融电解,得金屬鋰。
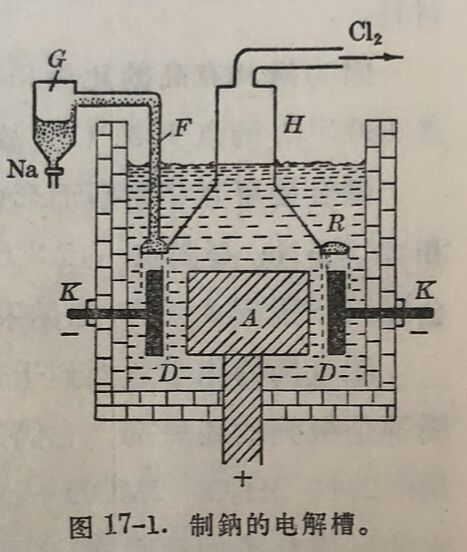
鈉可以直接电解熔融的食盐而制得。但是直接电解氯化物,不仅需要很高温度,而且电解析出的金屬分散在熔融盐中,难以分离。若在食盐中另外加入其他氯化物,如氯化鈣等,-方面可以降低电解盐的熔点(氯化鈉的熔点为800°C,混合物的熔点約600°C),另一方面也可以使金屬分散的倾向减小。因为熔融混合物的密度比金屬鈉大,鈉可以浮在上面。
如图17-1所示的电解槽是由鋼壳构成,内衬耐火材料,以石墨A为阳极,以铁环K为阴极,两极之間装有网状隔膜D。在阳极上盖- .钟罩H,带有倒装的环形槽R,上面連以铁管F,通过管F液体鈉可流至收集器G中。混合盐在电解槽中熔化后,进行电解,反应如下:
在阳极上: 2Cl⁻=Cl₂+2e
在阴极上: 2Na⁺+2e=2Na
这样电解所得的鈉含有約1%的鈣。电解熔融的氢氧化鈉也得金屬鈉,純度可达99.9%。
在真空的条件下,用碳还原K₂CO₃可得金屬鉀:
近年来制备銣和銫的簡便方法是在具空中用鈣还原碘化銣和氟化銫。
二、碱金屬的性质和用途
碱金属都秸成体心立方晶格。由于每个金属原子只有一个价电子,而且在晶格中的原子之間的引力很弱,故破金属的熔点、硬度、密度皆很低;由于这些价电子在晶格内极为活动,故碱金属有很高导电性,有的在光照射下就能将电子釋放出来,如它具有光电效应。对光特别灵敏的是銫,因而它是制造光电池的一种优良材料。
因为鋰具有高的比热和导热率,而且熔化的温度范圉很大(熔点180.5°C,沸点1331°C),故非常适合于作鈾反应堆中的冷却剂。 碱金屬可互相溶解而形成合金,如鉀鈉的液体合金(77.2% K和22.8%Na,凝固点-12.3°C)。液态鈉用作反应堆的导热剂。破金属溶于汞形成汞齐,如鈉汞齐在有机合成上用作还原剂。
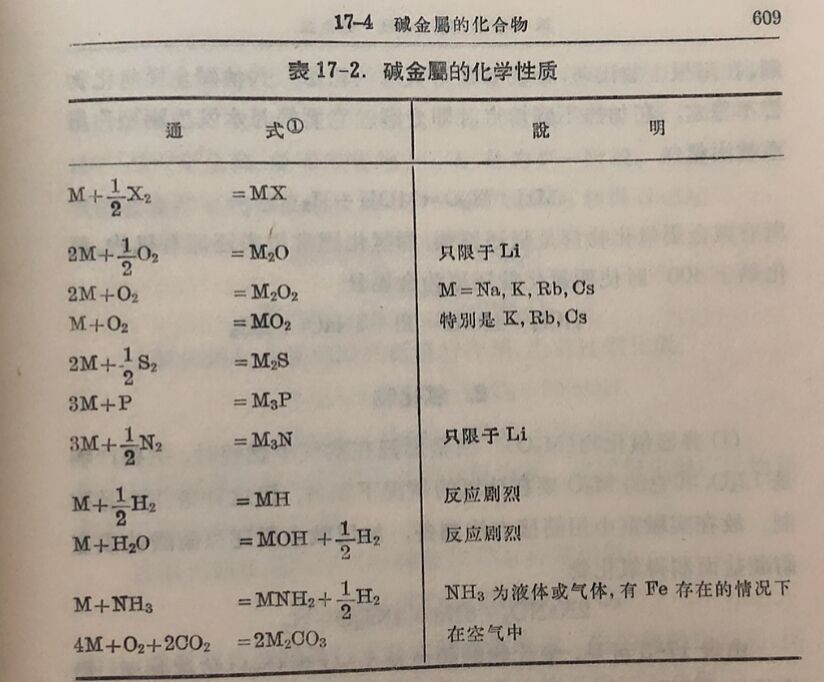
碱金屬的化学通性列于表17-2。从标准电极电位可見,碱金屬都是极强的还原剂。它們的化学活性首先表現在与水的剧烈作 用: 2M+2H₂O= 2MOH+H₂。鋰的活潑性应比鈉高,但实际上与水的反应并不如鈉剧烈,这是因为鋰的熔点較高,反应所产生的热不足以使它熔化,而鈉与水反应时放出的热可使鈉熔化,固体理与水接触的机会不如液体鈉。而且,反应产物LiOH在水中溶解較难,它复盖在鋰的表面,也使反应速度降低。
碱金屬的化学活性也表現在与电负性較高的非金属元来,如硫、氧、卤素以及氢的直接作用。所形成的化合物比任何其它金册的相应化合物稳定得多。这里应当指出,碱金屬在氧中燃烧时所生成的氧化物是不同的:鋰生成氧化物,Li₂O;鈉生成过氧化物,Na₂O₂;鉀、銣、銫生成超氧化物,K₂2、RbO₂、CsO₂。
在沸点时碱金屬的蒸气主要是单原子,但含有约1%双原子分子,它們的离解能是随原子量的增加而递减。这些双原子分子的存在是碱金屬可以形成共价键的证明。