

























































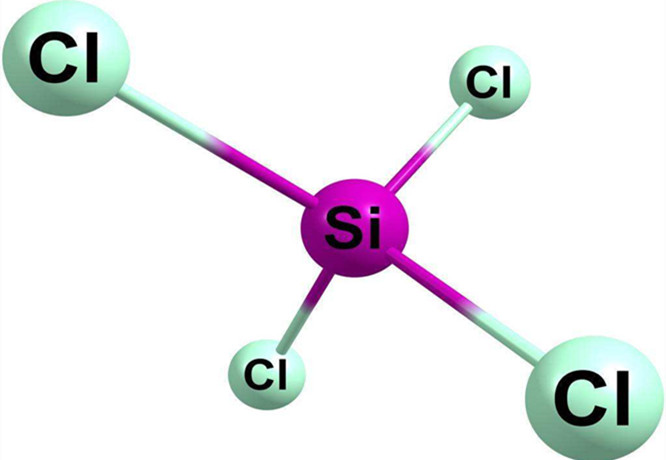
硅硼的卤化物
| SiF4 | SiCl4 | SiBr4 | SiI4 | BF3 | BCl3 | BBr3 | BI3 | |
| 室温下存在状态 | 气 | 液 | 液 | 固 | 气 | 液 | 液 | 固 |
| 熔点/K | (升华)183.0 | 203.2 | 278.6 | 393.7 | 146.5 | 165.9 | 227.2 | 323.1 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 | 173.3 | 285.7 | 364.5 | 483.2 |
| 生成热△Hf°/(kJ·mol-1) | -1614.9 | -687.0 | -457.3 | -189.5 | -1137.0 | -427.2 | -239.7 | 71.1 |
| X3Si-X*/(kJ·mol-1) | 565 | 381 | 310 | 234 | 644 | 456 | 377 | 381 |
* 表示卤素
硅的卤化物都是共价化合物,熔点、沸点都比较低,氟化物、氯化物的挥发性更大,易于用蒸馏的方法提纯它们,常被用作制备其它含硅化合物的原料。例如:99.99%的SiF4是制太阳能电池用的非晶态硅的原料。SiCl4主要用于制硅酸脂类、有机硅单体、高温绝缘漆和硅橡胶,还用于制光导纤维所需要的高纯度石英。
这些卤化物同CX4相似,都是非极性分子,以碘化物的熔点、沸点最高,而氟化物最稳定。所不同的是硅的卤化物强烈地水解,它们在潮温空气中发烟,如:
SiCl4(l)+3H2O(l)=H2SiO3(s)+4HCl(aq)
SiCl4可作烟雾剂。
但是CCl4不水解。这与Si有3d轨道,配位数为6,能同H2O配位,而碳原子不具备此条件有关。
由于同一原因,SiF4很容易与F-形成SiF62-配离子。
SiF4+2F-=SiF62-
Si—F的键能(565kJ·mol-1)比C—F的键能(485kJ·mol-1)大;所以SiF4比CCl4稳定。CF4于1273K分解而SiF4在此温度下不分解。
硅的卤化物可以用下列方法制取:
(1)硅与卤素直接化合
由于Si—F键能大,Si与F2在常温下就生成SiF4。其它卤化物在升温条件下也可以得到。
(2)氧化物与氢卤酸或卤化物作用
SiO2(s) + 2CaF2(s) + 2H2SO4(l) =(加热) SiF4(g) + 2CaSO4(s) + 2H2O(l)
(石英砂) (萤石)
(3)氧化物与焦炭的混合物经过氯化处理
SiO2(s)+2C(s)+2Cl2(g)=SiCl4(g)+2CO(g)
当SiF4水解时,未水解的SiF4极易与水解产物HF配位形成氟硅酸H2SiF6。
SiF4+2HF=H2SiF6
现在还未制得游离的H2SiF6,只能得到60%的溶液。它是一种强度相当于H2SO4的强酸。以SiF62-和H3O+离子形式存在于水溶液中。金属锂、钙等的氟硅酸盐溶于水;钠、钾、钡的盐难溶于水。用纯碱溶液吸收SiF4气体,可得到白色的氟硅酸钠 Na2SiF6晶体。
3SiF4+2Na2CO3+2H2O=2Na2SiF6↓+H4SiO4+2CO2↑
生产磷肥时,利用此反应以除去有害的废气SiF4,同时得到很有用的副产物Na2SiF6。Na2SiF6可作农业杀虫剂,搪瓷乳白剂及木材防腐剂等。它有腐蚀性,灼热时将分解为NaF和SiF4。

SiF4与碱性氟化物反应,也可以得到氟硅酸盐。
SiF4+2KF=K2SiF6
K2SiF6用于制太阳能级的纯Si(含量99.97%)。