


































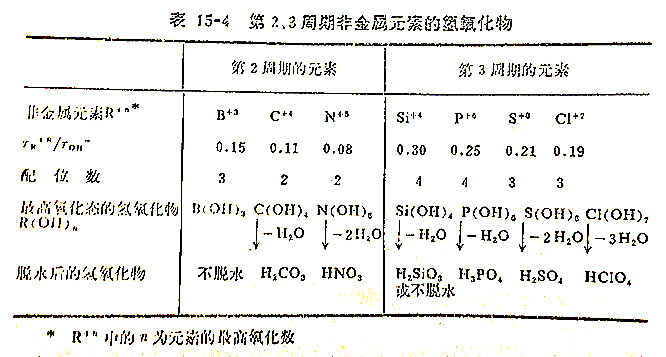
非金属元素氧化物的水合物为含有一个或多个OH基团的氢氧化物。作为这化合物的中心原子,即非金属R,它周围能结合多少个OH,取决于R+的电荷数及半径大小。一般说来,R+n的电荷越高,半径越大,能结合的OH-基团数目越多。但是当R+n的电荷很高时,其半径往往很小,例如Cl+7应能结合七个OH基团,但是由于它的半径太小(0.027nm),容纳不了这许多OH,势必脱水,直到Cl+7周围保留的异电荷离子或基团数目,既能满足Cl+7的氧化数又能满足它的配位数,而配位数与两种离子的半径比值有关。处于同一周期的元素,其配位数大致相同。表15-4列出了第2、3周期非金属元素最高氧化态氢氧化物的组成。
若以R—O—H表示脱水后的氢氧化物,则在这分子中存在着R—O及O—H两种极性键,ROH在水中有两种离解方式:
ROH→R++OH-碱式离解
ROH→RO-+H+酸式离解
ROH按碱式还是按酸式离解,与阳离子的极化作用有关。阳离子的电荷越高,半径越小,则这阳离子的极化作用越大。卡特雷奇(Cart-ledge,G.H)曾经把这两个因素结合在一起考虑,提出“离子势”的概念,用离子势表示阳离子的极化能力。
离子势即阳离子电荷与阳离子半径之比,常用符号φ表示如下:
φ=阳离子电荷/阳离子半径=Z/r
例如:Na+的电荷Z=+1,离子半径r=0.097nm,φNa+=10
Al3+的Z=+3,r=0.051nm,φAl3+=59
这个概念也适用于带电荷的原子如B+3、S+6或Cl+7等以及阴离子。如:S+6的Z=+6,r=0.030nm,φs+6=200
在ROH中,若R+n的φ值大,即其极化作用强,氧原子的电子云将偏向 ,从而使O—H键的极性增强,所以ROH以酸式离解为主。
,从而使O—H键的极性增强,所以ROH以酸式离解为主。
如果R+n的φ值小,R—O键比较弱,则ROH倾向于作碱式离解。有人找出用φ值判断ROH酸碱性的经验公式如下:
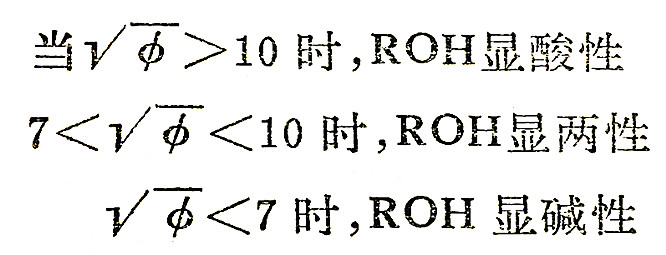
总而言之,R+n的值大,ROH是酸;φ值小,ROH是碱。非金属元素的φ值一般都较大,所以它们的氢氧化物为含氧酸。
离子化合物的许多性质,如溶解性,盐类的热稳定性、水解性以及离子形成配合物的能力等等都与阳离子对阴离子或偶极分子的静电引力有关。因此,用离子势可以说明离子化合物的这些性质。周期表中出现的对角线上元素性质相似的规律也常用离子势解释。
不过,φ=Z/r是从事实经验导出的,它不能符合所有事实。也有人用Z/r2或Z2/r等等其它函数式来表示离子的极化能力以符合另一些事实。不论其表示方法如何,都说明离子的电荷-半径比是决定离子极化程度大小的主要因素。
