























铜有氧化数为+Ⅰ和+Ⅱ的化合物。从离子结构来说,Cu+的结构是3d10,应该比Cu2+(3d9)稳定。铜的第二电离势(1970kJ·mol-1)较高,故在气态时Cu+的化合物是稳定的。从反应2Cu+(g)=Cu2+(g)+Cu(s)的△H°=866.5kJ·mol-1来看亦是Cu+(g)的化合物较稳定。但在水溶液中,Cu2+(电荷高、半径小)的水合热(2121kJ·mol-1)比Cu+的(582kJ·mol-1)大得多,据此可以说明Cu+在溶液中是不稳定的,它会歧化为Cu2+和Cu:
2Cu+ ⇋Cu+Cu2+
从下列铜的电势图也可以说明:
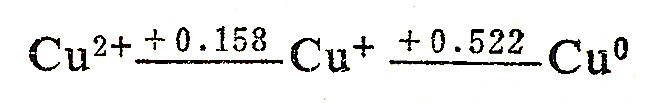
由电势图可见,E°右>E°左,Cu+变成Cu和Cu2+的歧化趋势大,在293K时,此歧化反应的平常数K=[Cu2+]/[Cu+]2=1.4×10(6次方)。由于K很大,溶液中只要有微量的Cu+存在,就几乎全部转变为Cu2+和Cu。所以在水溶液中,Cu2+化合物是稳定的。例如,将Cu2O溶于稀H2SO4中,得到的不是Cu2SO4而是Cu和CuSO4:
Cu2O+H2SO4=Cu+CuSO4+H2O
Cu+只有当形成沉淀或配合物时,使溶液中Cu+浓度降低到非常小,反歧化的电动势升高到E°>0,反应才能向反方向进行,例如,铜与氯化铜在热浓盐酸中形成一价铜的化合物:
Cu+CuCl2=2CuCl
CuCl+HCl=HCuCl2
由于生成了配离子[CuCl2]-,溶液中Cu+浓度降低到非常小,反应可继续向右进行到完全程度。前面讲到的Cu2+离子与I-反应由于生成CuI沉淀,也使反应能向生成CuI的方向进行。可见在水溶液中,Cu+的化合物除不溶解的或以配离子的形式存在外,都是不稳定的。

由于Cu2+的极化作用比Cu+强,在高温下,Cu2+化合物变得不稳定,受热变成稳定的Cu+化合物。例如,氧化铜加热到1273K以上,就分解为O2和Cu2O:
4CuO=2Cu2O+O2
其它如CuS、CuCl2、CuBr2加热至高温都有分解为相应的Cu+化合物的现象。甚至有些化合物如CuI2、Cu(CN)2在普通常温下,就不能存在,要分解为Cu+化合物。可见两种氧化数的铜的化合物各以一定条件而存在,当条件变化时,又相互转化。
