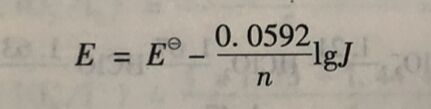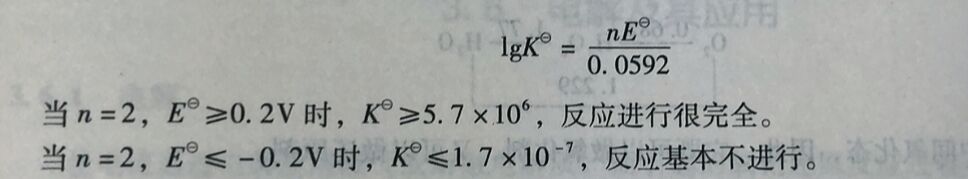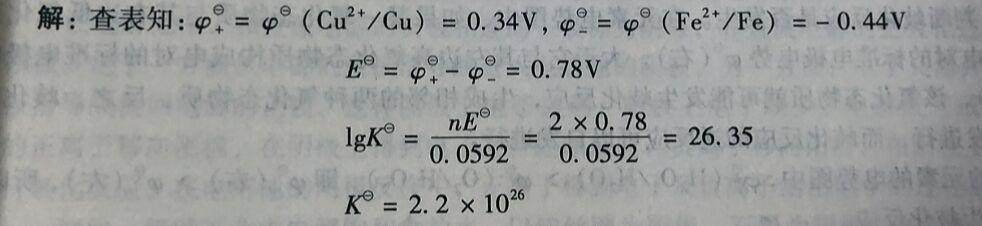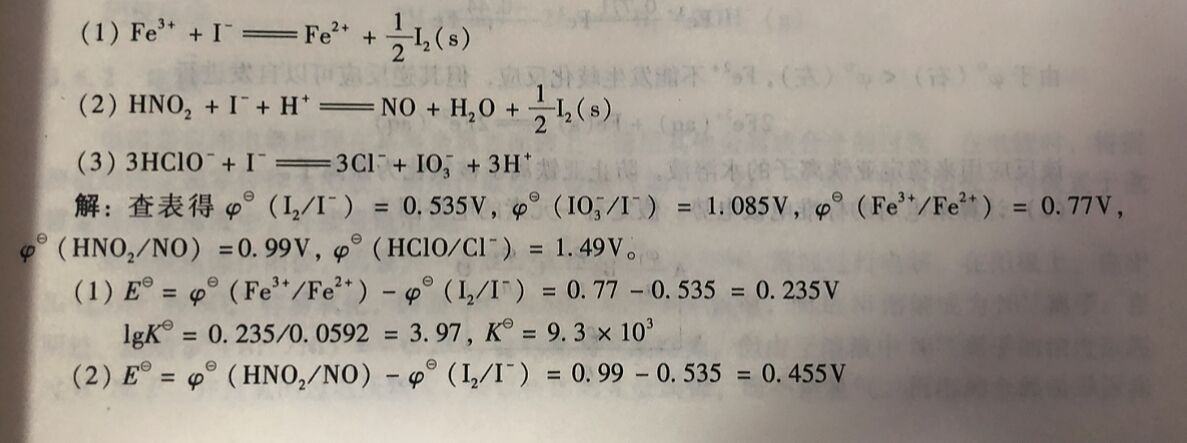例3-13在标准状志下, 将金属钢分别浸入FeCl₃,和盐酸常液中,能否生成Cu²⁺?
例3-14 (1) 判断反应MnO₂(s) +4HCl(aq)一MnCl₂(an) +Cl₂(g) + 2H₂O(l),在298K和标准状态下能否自发进行。
例3-15在0.5mol/dm³ H₂SO₄溶液中,MnO₄⁻能否将Br⁻氧化为Br₂?在pH =5的介质中,MnO₄⁻能否将Br⁻氧化为Br₂?
3.5.3计算氧化还原反 应进行的程度
根据电池反应的Nernst方程式(25°C):
当氧化还原反应处于平衡时,E=0,J=K,则氧化还原反应平衡常数与标准电池电动势的关系为
例3-16 计算反应Cu²⁺(aq)+Fe(s)⇔Fe²⁺(aq)+Cu(s)在298K时的平衡常数K
例3-17在制碘厂, 原料海带用自来水浸泡30min, 90% ~95%的碘以I离子进人水中, 浓度约0.4g/dm³。然后加人氧化剂使碘析出。计算碘离子与不同氧化剂(Fe³⁺、 HNO₂、HCIO)反应时的平衡常数。



















































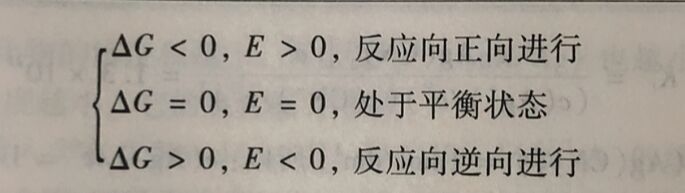



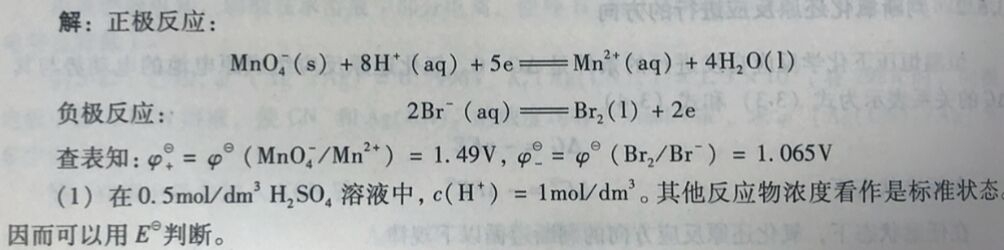
.jpg)