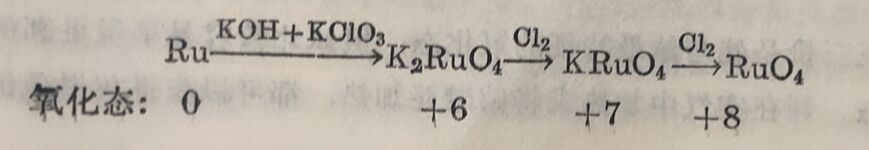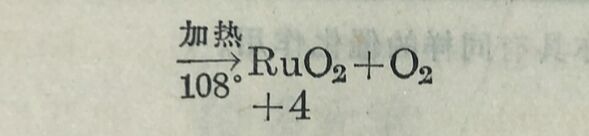鉑系元素
铜臭 / 2022-08-10
一、鉑系元素的存在和用途
鉑系元素几乎完金以单质状态存在,高度分散于各种矿石中,例如原鉑矿,硫化鎳銅矿,磁铁矿等皆含有鉑系金屬。它們几乎无例外地共同存在,也有彼此形成合金而存在,例如,原鉑矿常有銀、銥合金存在。在原鉑矿中通常以鉑为主要成分,但在南非洲亦有鉑和鈀含量近乎相等的原鉑矿。要使鉑和鉑系的其他元素完全分离,以及使除鉑以外的鉑系元素相互分离,在技术上有相当大的困难。
鉑系元素中以鉑的实际用途为最大,可以用它做化学实驗室或工厂实驗室中的各种器皿或仪器零件,如鉑坩堝、鉑蒸发皿、鉑电极等等。在电工技术中,制造电炉的加热钱圈和測定高溫的电阻高溫計及热电偶时亦要用到鉑。电阻温度計是根据網鉑絲的电阻在溫度升高时作有規律的增加,因而测量电阻后就可以测定温度。热电偶是利用两种不同的金屬絲彼此連接而构成的。如两端的接触点处于不同的温度下,則将有电流沿着线路通过。因为两种金厨紧密接触时,常常有一部分的自由电子从这一金屬轉移到另一.金属,所以在接触点形成接触电位差。假使两根不同的金厨絲彼此述接,而两端的二个接触点处于相同的温度下,則二个接触点产生相同的电位差,秸果互相抵滑,电位差等于零,裁路中就沒有电流通过。热电偶就是根据这个原理来测定温 度的。鉑和鉑銠合金(90%Pt, 10%Rh)就是常用的热电偶之一,可应用于 1200-1750°C 范園内。在化学工业的各种生产过程中,例如氨的氧化、硫酸的制造等,常用鉑作为催化剂。珠宝业和牙医业上消耗的鉑量亦很大。
銥常与鉑熔成合金,以增强鉑的硬度,金笔的笔尖就是由鉑銥合金制成的。在电工技术方面,鉑銥合金还有其他特有的用途。保存在巴黎的国际标谁米尺,也是用10%Ir和90%Pt的合金制成的。銀白色的鈀,除了应用于电学工业外,还可用来做各种装飾品,因为它的銀白色光澤比銀持久,不受硫化氢的影响。銀加入17-30% 的鈀后,就可避免因H₂S而变黑。銥和鋨的合金硬度极大,钟表机件中最重要的軸,就是用銥鐵合金制造的。这些金属在化学工业上亦常用作催化剂。例如粉末状的鈀或胶状鈀,是有机加氨反应中的催化剂,胶状銠亦具有同样的催化作用。
二、釕和鋨的化合物
生成正八价的化合物是釕和镜的特征,它們都能生成挥发性的四氧化物RuO₄和OsO₄,但是RaO₄只能在高温下显得比較稳定,在常温时它是处于介稳定状态。它只在不见光并且很干燥的情况下,才有可能保能,遇到有机物质,如酒精之类,立即起爆炸反应,被还原成黑色的RuO₂。它对于橡皮亦有强烈的腐触作用。OsO₄虽亦会被酒精或瓶蜡等物质还原面成OsO₂,但作用比較暖和得多。RuO₄和OsO₄都是强氧化剂,但是它們的稳定性差制很大,RuO₄的稳定性比OsO₄差,亦就是RuO₄的氧化能力比較强。在酸溶液中,这种差别可由下列标准电位表明:
OsO₄+8H⁺+6Cl⁻+4e=OsCI₆⁻⁻+4H₂O E⁰=10伏
RuO₄+7H⁺+5Cl⁻+4e=RuCl₅OH⁻+3H₂O E⁰=15伏
釕和氧直接化合时,通常得些黑色的二氧化釕RuO₂。粉末状的金屬釕或二氧化釕与氢氧化鉀及氯酸鉀(或硝酸鉀)混和后加热,即得深缘色的熔体溶入水中却又变成深红色溶液。将这深缸色溶波蒸发(勿与有机物接触),即析出釕酸鉀K₂RaO₂·H₂O的亮绿色雏形晶体。如在深缸色溶液中通入氢气,則先被氧化为高釕酸鉀KRuO₄而呈蒜色(KRuO₄是黑色晶体)。如继续通入氯气即 得RaO₄。RuO₄为金黄色針状晶体,25°时即熔解而成橙紅色液 体,达108°时即起爆炸性的分解,分解为RuO₂和O₂。K₂RuO₄很 容易被有机物还原为RuO₂。RuO₂是釘的最稳定的氧化物。以上过程可总结如下:
KRuO₄加热到200°以上时,它就轉变为K₂RuO₄。KRuO₄用强破处理后,亦得 K₂RuO₄。K₂RuO₄溶液酸化时,就生成KRuO₄和RuO₂,因此KRuO₄和K₂RuO₄的相互关系,颇与KMnO₄和K₂MnO₄的关系类似。与K₂RuO₄相当的鋨酸鉀K₂OsO₄极不稳定,很容易氧化而成OsO₄。K₂OsO₄虽亦可以从OsO₄在KOH溶液中还原(用KNO₂等还原剂)面制得,但在空气中稍稍加热即得OsO₄。这亦說明OsO₄比RuO₄稳定得多。OsO₄呈淡黄色。OsO₄和RuO₄的蒸气都有刺激异臭,且很毒,都能溶解在水中。
从釕和鋨的卤化物亦可以看出+8价是鋨的比較特征性的氧化态。金屬鋨粉与氟在250°以上即反应而成无色的氟化鋨OsF₈蒸气,用固态CO₂使它冷却即凝成檸檬黃色晶体(熔点34.4°,沸点47.5°),亦可能同时有綠色的OsF₆晶体生成。但OsF₆遇水即分解为OsO₄、OsO₂及HF,而OsF₈則比較稳定,溶解后得一清澈的溶液。鋨与氯仅能在650°以上反应而得四氯化鋨OsCl₄。至于釕了和卤素的反应則完至不同于鋨,在生成的卤化物中,釕的氧化态都比鋨在相应卤化物中的氧化态为低。釕粉在300°左右(在鉑管中加热)始与氟反应而成五氟化釕RuF₅,其中混有少量RuF₃等低价氟化物,还有較多的氟化鉑。RuF₅呈深綠色,熔点为101°,沸点在250°以上。釕与氯則仅能在熾热高温下直接反应而成三氯化釕RuCl₃。RuCl₄是RuO₄被HCl还原过程中的中間产物。