硅化物
铜臭 / 2022-07-28
硅与电正性較高的元素,特别是金属元素化合而产生的二元化合物称为硅化物。它們与上面所討輪的碳化物相对应。由于硅的电負性較碳为低,故硅化物与金属型碳化物較为相似。大多数的硅化物皆有金属的光澤,高导电性和高熔点,对水和稀酸皆稳定。它們的成分与組分元素的原子价无明显关系,如铁有FeSi₂、 FeSi、Fe₃Si₂,鈷有CoSi₃, CoSi₂, CoSi, Co₃Si₂、 Co₂Si等組成的硅化物。此外,少数的碱土金属的硅化物M₂Si(M=Mg、Ca、Sr、Ba)和化鋰LisSi(其他碱金屬不与硅作用)皆为水和稀酸所分解,故与离子型的碳化物較相似。金屬硅化物的一般制法是将其粗分一同熔化或用适当过量的相应金属使二氧化硅还原。
一、硅的氫化物
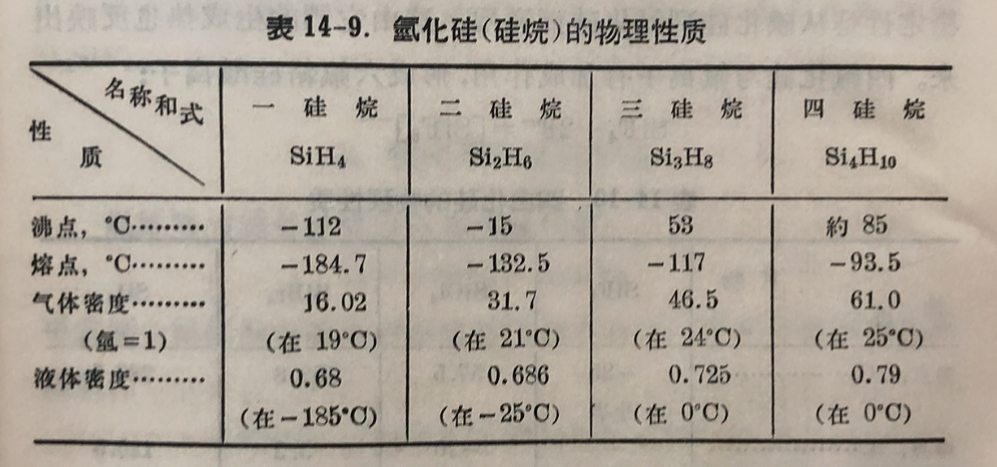
与烷系碳氫化合物相类似,硅氩化物的粗成也可以通式 SinH₂n₊₂ 表之,物理性质也多相类似。因此,硅的氫化物又称为硅烷。羥典的制法是在氢氧流丙加稀盐酸于硅化鎂, 所产生的气体为氫和几种不同的氨化硅的混合物,加以分餾即可将各租分分开。 混合氩化物中約含40% SiH₄、30%Si₂H₆、15%Si₃H₈、10%Si₄H₁₀和5%分子量更高的硅烷。由硅化鎂和盐酸作用而产生硅烷的过程是相当复杂的,但总的反应可以下式表示:
Mg₂Si+4HCl=SiH₄+2MgCl₂
4Mg₂Si+16HCl=Si₄H₁₀+8MgC₂g+3H₂
現将最簡单的几个硅烷的性质列于表14-9内。由表内数据可見
硅的氫化物皆为共价化合物,它們的揮发性和熔点等性质皆随分子量的增高而递变。它們与空气或氧一接触即自动燃烧,对热也不稳定,分子量愈高,愈易分解。硅烷在硅石的容器内虽然不与純水起作用,但水内只要有微量碱质,如加入少許玻璃屑,即发生分解作用:
SiH₄+4OH⁻=SiO₄⁴⁻+4H₂
这是由于它对氩氧离子有非常强的敏感性。硅烷是强还原剂,可使高錳酸盐还原为二氧化錳,汞⁽ᴵᴵ⁾还原为汞⁽ᴵ⁾或汞⁽⁰⁾,銅⁽ᴵᴵ⁾还原为氨化銅等。用卤化鋁为催化剂,在100°C时,氯化氫或溴化氫可将硅烷的氢逐一用氯或溴取代,形成SiH₃Br、SiH₂Br₂、SiHBr₃和SiBr₄。