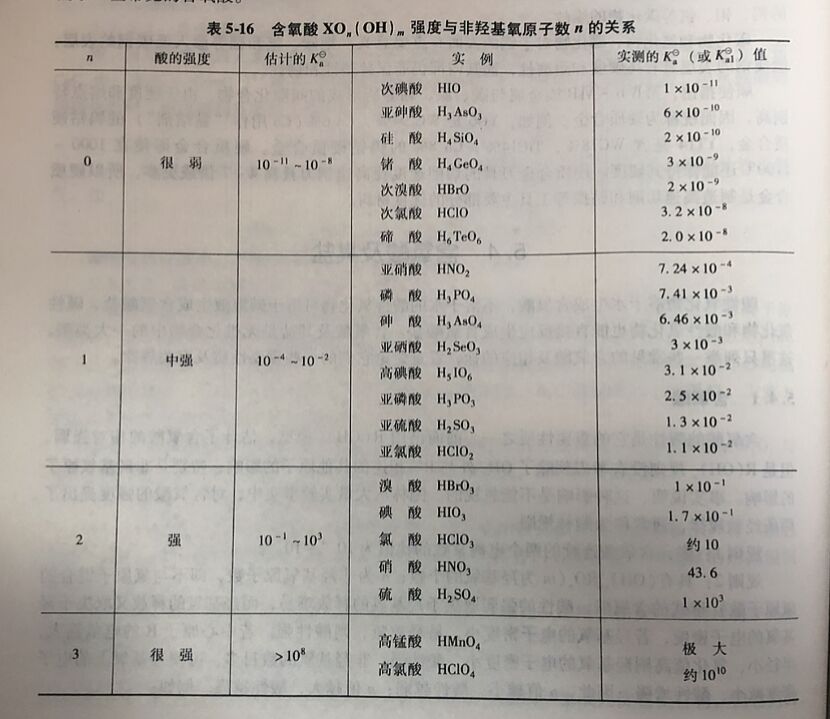
鲍林总结的含氧酸强度规则只是经验的总结,尚有不少例外。实际上,影响元素含氧酸酸碱性的因素很多,目前尚无圆满解释。
5.4.2 含氧酸盐的热稳定性
含氧酸盐有正盐,如CaCO₃;酸式盐,如Ca(HCO₃)₂和碱式盐,如Ca₂(OH)₂CO₃。通常所说的含氧酸盐是指正盐。
含氧酸盐的热稳定性与对应的含氧酸的热稳定性有关。一般来说, 含氧酸的热稳定性差,则对应的含氧酸盐的热稳定性也较差,如碳酸盐、亚硝酸盐、硝酸盐等。含氧酸较稳定,则对应的含氧酸盐也稳定,如硫酸盐、磷酸盐等。
含氧酸盐的热分解通常是吸热反应,加热有利于热分解。例如碳酸钙的热分解
CaCO₃(s)=CaO(s) + CO₂(g)
由反应方程式知KΘ=p(CO₂),若升高温度,则KΘ值增大,即CO₂的压力增大。在一定温度下,碳酸盐的热分解反应达到平衡时系统中二氧化碳的分压,称为在该温度下碳酸盐的分解压。碳酸钙的分解压随温度的升高而增大,或者说碳酸钙的热分解温度随CO₂的分压的增大而 升高。在空气中CO₂的含量不大,一般约为0.03% (体积分数),即空气中CO₂的分压为
p(CO₂)≈0.03% x 101. 3kPa≈30Pa
当温度高于530°C时,碳酸钙分解出的CO₂的压力大于30Pa,也就是大于周围空气中CO₂的分压,引起生成物CO₂的不断扩散,导致碳酸钙的不断分解。因此,530°C 是碳酸钙在空气中开始分解的温度,但这时分解速率很小。当温度达910°C时,碳酸钙分解出CO₂的压力为 101. 3kPa,等于周围空气的总压力,就会产生“ 沸腾”现象,碳酸钙剧烈分解。碳酸盐分解温度通常有两个,一个是开始的温度,如CaCO₃为530°C;另一个是剧烈分解的温度,如CaCO₃为910°C,通常所说的分解温度是指后者。
习惯上把CO₂的水溶液称作碳酸,而纯的碳酸至今尚未制得。碳酸很不稳定,室温下易分 解。酸式碳酸盐也不稳定,如NaHCO₃( 俗名小苏打)在水溶液中50°C就分解,固态时270°C分解。碳酸盐比相应的酸式碳酸盐稳定得多,如Na₂CO₃在850°C熔化时仍不分解。除活泼金属的碳酸盐外,其他碳酸盐的热稳定性较差。
硫酸比碳酸稳定,硫酸盐也比碳酸盐稳定。碱金属和碱土金属的硫酸盐在强热时只熔融而不分解,但过渡金属的硫酸盐强热时分郦成金属氧化物和SO₂,某些金属氧化物还可进一步分解成单质。例如
AgSO₄=Ag₂O+SO₃↑
Ag₂O=2Ag+1/2O₂↑
酸式硫酸盐不如正盐稳定,例如NaHSO₄在315°C时就分解。
硝酸容易分解,所以硝酸盐的稳定性很差。即使是活泼金属的硝酸盐也易分解。硝酸盐热分解产物依赖于金属离子的性质,碱金属和碱土金属的硝酸盐分解时产生亚硝酸盐和氧气。如
2NaNO₃=2NaNO₂+O₂↑
活泼性在镁和铜之间的金属硝酸盐,热分解时生成相应金属的氧化物,如
2Pb(NO₃)₂=2PbO+4NO+3O₂
比铜不活泼的金属的硝酸盐,热分解时生成相应的金属单质。如
AgNO₃=Ag+NO↑+O₂↑
对亚硝酸及其盐来说,亚硝酸不能自由存在,亚确酸盐却相对稳定,但亚硝酸盐在加热时也能分解,如
4NaNO₂=2Na₂O+4NO↑+O₂↑
硝酸盐和亚硝酸盐的分解产物含有氧气,它们在高温时是强氧化剂,加热时要防止带人木换、油类和棉布等可燃性物质,以免引起剧烈燃烧,甚至爆炸。
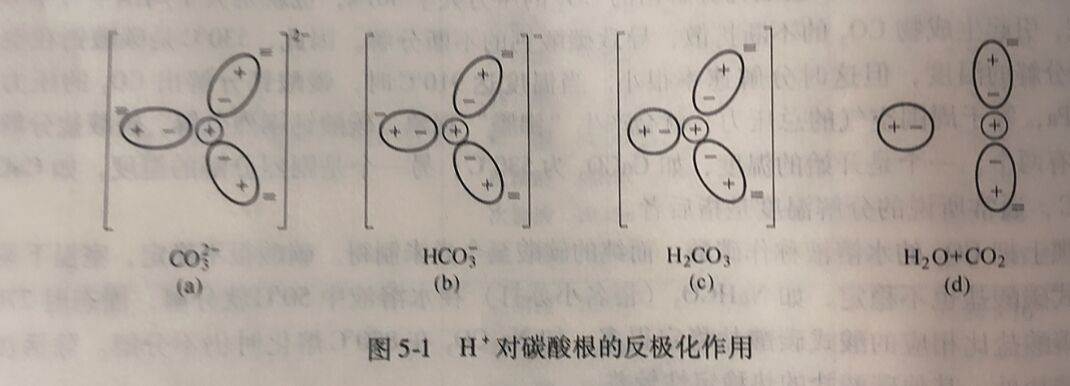
碳酸和碳酸盐的热稳定性与阳离子的反极化作用有关。以碳酸为例说明H⁺对碳酸根的反极化作用,见图5-1。
在CO₃²⁻中碳和3个氧原子之间的化学键是等同的,碳用sp²杂化轨道与3个氧原子结合, 4个原子在同一平面上形成一个三角形(图5-1 (a))。在碳酸根中,位于中心的C⁴⁺对周围的O²⁻有极化作用,导致O²⁻极化变形,原子轨道重叠,形成强共价键。当H⁺离子靠近O²⁻离子时,H⁺离子对O²⁻离子有极化作用。H⁺离子极化作用和中心离子的极化作用方向相反,称为 反极化作用。H' 的体积很小,又没有带负电荷的电子云,它可以钻人碳酸根内O²⁻的电子云 中,降低O²⁻的负电荷,同时降低O²⁻的变形性,削弱C⁴⁺与O²⁻间的共价键(图5-1 (b))。在酸式碳酸根中,由于其中一个O²⁻的电荷降低,变形性降低,所以它和中心离子C⁴⁺间的键 变得不稳定了。当再有一个H⁺钻入O²⁻电子云中去时,就形成碳酸分子(图5-1 (c))。 因为 C⁴⁺中心离子对电中性分子作用不大,碳酸分解成为CO₂和H₂O (图5-1 (d))。