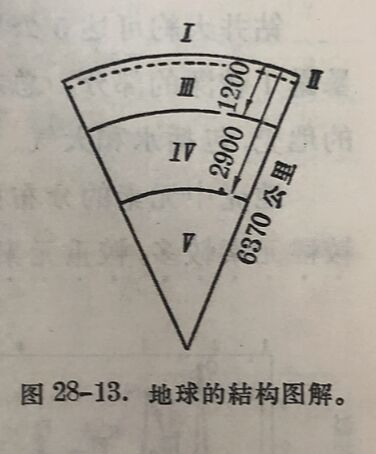
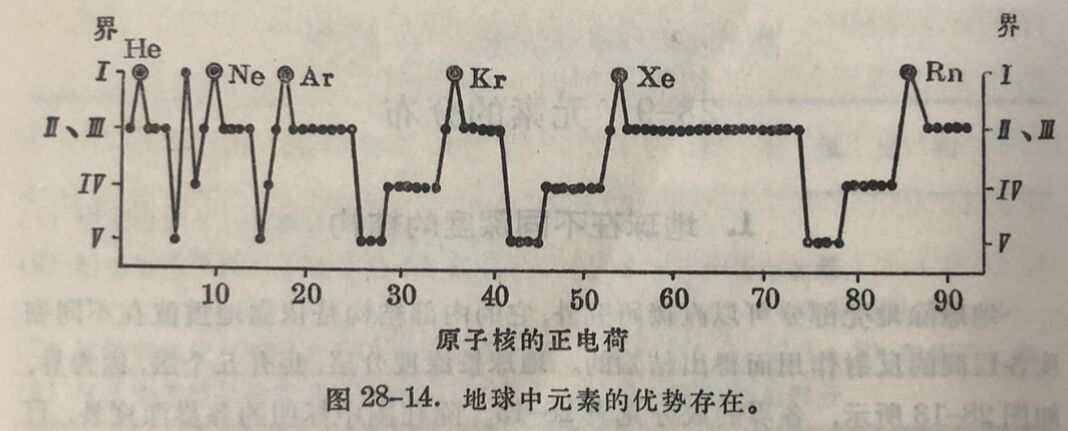
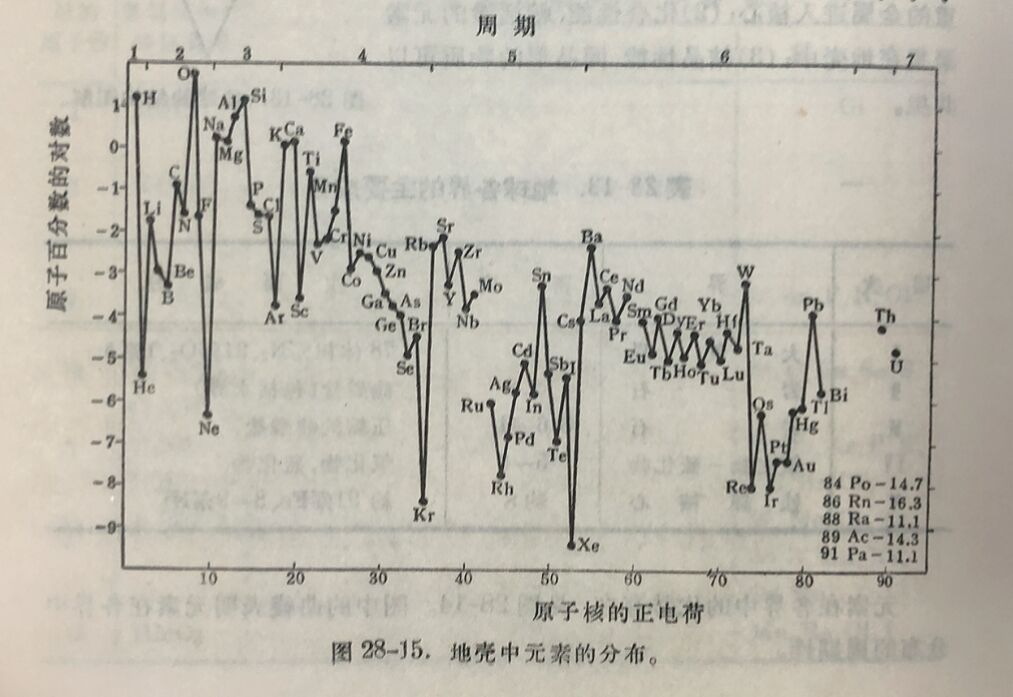
元素在地壳中存在的多寡,叫做丰度。丰度可用重量百分表 示,称为重量克拉克(clark)。 按克拉克的数量級,可将元素按丰度分为十类(当然也可以分为較多类),如表28-14所示。
表28-14 地壳中元素的丰度
|
重量克拉克数
量级
|
元素 |
元素数目 |
| 10¹ |
O Si |
2
|
| 10⁰ |
Al Fe Ca Na K Mg H
|
7 |
| 10⁻¹ |
Ti C Cl P S Mn |
6 |
| 10⁻² |
F Ba N Sr Cr Zr V Ni Zn Cu B |
11 |
| 10⁻³ |
Rb Li Y Cl Co Th
Nd Pb Mo Br Be Ga
|
12 |
| 10⁻⁴ |
U W Yb Dy Gd Sm Er La Sn
Sc Cd As Pr Hf Ar Ge
Lu Cs Hg Tu Ho Tb I
|
23 |
| 10⁻⁵ |
Se Sb Nb Ta Eu In Bi Tl Ag |
9 |
| 10⁻⁶ |
Pd Pt Ru Os Au Rh Ir Te He |
9 |
| 10⁻⁷ |
Ne Re |
2 |
| ≤10⁻⁸ |
Kr Xe Ra Pa Ac Po Rn Pu Fr At |
10 |
由表可見,如鈦、鋯、釩所謂稀有元素,在地壳中要比普通元素碘、汞、砷多得多,也比鉛、銅、鋅来得多,可是很分散。銻在地壳中含量很少(10⁻⁵克拉克数量級),可是它在我国是一个丰产元素。值得提到的是約有四分之一的元素(絕大多數是稀有元素)是以10⁻⁴克拉克数量級存在的。总之元素的丰度是极不均匀的,最丰的一个元素已占約50%;最丰的两个元素占至部元素的75%。最丰的12个占99.50%,其次的12个占0.45%,再次的12个占0.04%。也就是說,最丰的36个元素(約至部元素数目的三分之一)已占99.99%,而其他約三分之二的元素仅占0.01%。
元素在宇宙間的分布,可以从星球的光譜和射到地面上的隕石而略梗概。分布曲线的一-般趋势虽和地壳内的分布曲线(图28-15)相仿,但是占有最高峰的是H,其次是He,不象地壳中最丰的是O,其次是Si。在星云中,主要含H、He等最輕的元素。这些元素进行“聚变”的核反应,生成重元素,同时釋放巨大的能量,发出宇宙线。
二、周期律是現代化学研究的南針
我們在这本教程中,最初在指出化学的内容时說,化学是研究物质及其变化的科学,就是研究质变的科学。尤其是无机化学,以全部元素作为研究的对象。一百多种元素,数以百万計的已知化 合物,如果不能把繁复紛耘的对象和現象納入一个体系之内,那末化学工作者势必堕入五里雾中。俄罗斯偉大化学家門捷列夫所发現的周期律,对化学的学习和研究起着提網挈領的作用,从而使化学成为一个有系統的科学。
直接受到周期律指导的科学部門,除无机化学外,还包括分析化学、有机化学、物理化学、物理学、地球化学、生物科学、农业科学等各方面。
周期律不但对放射性元素蛻变系統的同位素的研究是一个很大的帮助,它对于原子核秸构的規律性也指引着探索的途徑。井且象超鈾元素的合成以及重核裂变的研究,也是以周期律为基础的。这些研究对于原子能的和平利用有着巨大的意义。
分析化学是以元素性质間的同一性和特殊性为根据,因而受到了周期律的支配。有机化合物分子中各原子間的相互影响是取决于有着周期变化的电负性的。
碳在周期表中的特殊地位,决定了这一元素的原子之間能构成稳定的长键和各式各样的环,致使物质有发展到有机界的可能。从以具有蛋白质及细胞为主要特征的生物体发展到具有最高运动 形式——思稚的人脑, 都是和碳作为第四族第一个元素这一事实分不开的。
周期律便利了物理化学方而的研究。无論在同族中由上而下或在同列中自左至右,如反应热、自由能、生成热等重要常数呈現着规律性的变化。同样,在物理学中原子光蹭线的波长也有着类似的规则变化。不仅这些,周期系还帮助着原子结构和分子结构的關釋。
元素周期学說推动了一个新的科学部門——地球化学——的建立。苏联学者維尔那茨基和费尔斯曼据以論列了元素在地壳中的散布状况。此外, 生物体需要的元素集中在周期表中的所謂“营养线”(短表中由碳画一直钱至鉀,另一直钱至铁)上及其附近。又如农业上所用虫药的主要元素在周期表中也占着一定的区域。
門捷列夫元素周期系是人类认識自然和改造自然的偉大学說。


























![1,8-二氮杂二环[5.4.0]十一碳-7-烯](images/201812/thumb_img/1103_thumb_G_1545291985569.jpg)